
ВИРУСНЫЕ И ДРУГИЕ БОЛЕЗНИ RUBUS, ПЕРЕДАЮЩИЕСЯ ЧЕРЕЗ ПОЧВУ
КОЛЬЦЕВАЯ ПЯТНИСТОСТЬ МАЛИНЫ И БОЛЕЗНИ, ВЫЗЫВАЕМЫЕ СОВМЕСТНЫМ ДЕЙСТВИЕМ ВИРУСОВ КОЛЬЦЕВОЙ ПЯТНИСТОСТИ МАЛИНЫ И ЧЕРНОЙ КОЛЬЦЕВОЙ ПЯТНИСТОСТИ ТОМАТА
Синонимы. Raspbery leaf curl [111]; raspberry (Scottish) leaf curl [3]; Lloyd George yellow blotch (?) [50]. Все эти названия относятся к болезням, вызываемым одним вирусом кольцевой пятнистости малины (сокращенно RRV), хотя вирус черной кольцевой пятнистости томата (сокращенно TBRV) вызывает сходное заболевание.
История и географическое распространение. Название "курчавость листьев" (leaf curl) было применено Харрисом и др. [111] к передаваемой прививкой болезни сорта красной малины Норфолк Джайент, встречающейся в Шотландии. По-видимому, она была той же самой болезнью, которая впервые была отмечена в 1922 г. на растениях сорта Сеянец Бомфорта "В".
Было найдено, что вирус, переносимый соком и почвой, названный кольцевой пятнистостью малины (ВКПМ), вызывает это заболевание [38, 112, 114]. Подобный, передаваемый через почву вирус, родственный вирусу черной кольцевой пятнистости томата (ВЧКПТ) [214], был обнаружен на растениях сортов Моллинг Эксплойт и Сеянец "V" [114]. Теперь известно, что ВЧКПТ встречается на многих сортах, включая Норфолк Джайент, часто связанный с ВКПМ. Доказано, что оба вируса переносятся нематодой, и штаммы, встречающиеся в Шотландии, передаются тем же переносчиком Longidorus elongatus de Man [123, 233]. На большинстве сортов ВКПМ и ВЧКПТ вызывают скорее симптомы кольцевой пятнистости на листьях, чем курчавости листьев. Вследствие этого, а также потому, что болезнь, вызываемая ВЧКПТ, очень сходна с заболеванием, вызываемым ВКПМ на некоторых сортах малины, никогда раздельно не называлась. Кадмен [45] полагал, что "кольцевая пятнистость малины" было лучшим названием, чем "курчавость листьев", для болезни, вызываемой как одним, так и обоими вирусами. Однако кольцевая пятнистость малины этиологически отличается от кольцевой пятнистости американской красной малины, вызываемой вирусом кольцевой пятнистости томата (также переносится нематодой), и от курчавости листьев американской малины, вызываемой вирусом, переносимым тлями.
Болезнь сорта малины Ллойд Джордж, называемая "желтая пятнистость" [50], теперь, по-видимому, вызывается некоторым штаммом ВКПМ.
ВКПМ и ВЧКПТ широко распространены в Восточной Шотландии, хотя встречаются очагами, а сходные или родственные вирусы встречаются в других частях Англии и в континентальной Европе. На малине ВКПМ обнаружен в Шотландии, Англии и Нидерландах, а ВЧКПТ только в Шотландии. Ни тот, ни другой вирус не отмечался вне Европы, хотя нематода Longidorus elongatus, переносчик обоих вирусов, встречается также в Северной Америке, Африке и Индии.
Экономическое значение. ВКПМ, но не ВЧКПТ, вызывает летальное заболевание на некоторых сортах малины, при этом экономические потери могут быть значительными, если вспышка заболевания сильная. Урожаи толерантных сортов могут так же сильно снижаться, как в случае с ВЧКПТ на сорте Моллинг Эксшюйт [238]. Поскольку на ранних стадиях заражения симптомы слабые или не проявляются, вирусы могут распространяться в посадочном материале; это может привести не только к потерям посадочного материала, но и к установлению вируса в почвах, уже содержащих нематод-переносчиков.
Круг растений-хозяев. Кроме видов Fragaria, Ribes, Rubus и Vitis, многие другие культивируемые и дикие растения могут быть естественно заражены обоими вирусами. Ниже перечисляются растения, которые были найдены зараженными ВЧКПТ. Растения, в которых также обнаружен ВКПМ, помечены звездочкой.
Культурные растения. АШит сера L. (лук), А. роrruum L. (лук поррей), Apium graveolens L. var. dilce Mill, (сельдерей), Beta vulgaris L. subsp. saccharifera (сахарная свекла), Brassica olearacea L. (капуста), В. napus L. (рапс), В napobrassi-ca DC. (брюква), В. rapa L. (турнепс), Cucumis sativus L. (огурец), Lactuca sativa L. (салат), Lollium perenne L. (райграс), Lycopersicum esculentum Mill, (томат), Medicago sativa L. (люцерна), * Narcissus pseudo-narcissus L. (нарцисс желтый),* Prunus avium (черешня), P. persica Batsch (персик), Solatium tuberosum L. (картофель), Trifolium repens L. (клевер белый).
Дикие растения.* Capsella bursa-pastoris (L.) Medic.,* Cerastium vulgatum L., Geranium dissectum L., Lamium amplexicaule L., * Myosotis arvensis (L.) Hill, Polygonum aviculare L., * P. convolvulus L., * Spergula arvensis L., * Stellaria media (L.) Cyrill., * Veronica agrestis L., * V. persica Poir.
В опытах по передаче нематодами-переносчиками многие виды растений заражались обоими вирусами. Почти все обычно используемые травянистые тест-растения чувствительны к местной или системной инфекции ВКПМ ,и ВЧКПТ при переносе их инокуляцией сока.
Кроме красной малины, ВКПМ был обнаружен и на куманике (Rubus fruticosus agg.). Восприимчивость сортов красной малины, к шотландским изолятам ВКПМ и ВЧКПТ определялась в опытах по передаче прививкой (см. табл. 9 на стр. 228). Сорта, иммунные к шотландским штаммам вирусов, обычно не заражались в полевых условиях в Восточной Шотландии. Однако недавно было установлено, что растения малины сорта Ллойд Джордж содержали форму ВКПМ, которая, как показано в таблице 9, способна заражать все испытанные до сих пор сорта малины (Мурант, С. Тейлор и Дж. Чамберс; не опубликовано). Эта форма вируса, по-видимому, является необычной и почти определенно была возбудителем желтой пятнистости на сорте Ллойд Джордж [50]. Сортовая восприимчивость к другим штаммам ВЧКПТ и ВКПМ не определялась детально, но английская форма ВКПМ была найдена в растениях нескольких сортов (см. табл. 9).
Симптомы. а) Малина. 1. ВКПМ. Как и в случае со всеми вирусными болезнями, переносимыми нематодами, вспышки заболевания встречаются очагами; они могут варьировать по размеру от нескольких квадратных метров до нескольких гектаров в зависимости от распределения в почве переносчика. Заметная хлоротичная кольцевая пятнистость появляется на листьях (рис. 76, вверху) обычно весной на следующий год после заражения, но она может стать менее заметной или исчезнуть полностью в середине лета, часто восстанавливаясь осенью. В дополнение к этому у сортов Сеянец Бомфорта "В" и Норфолк Джайент проявляются типичные симптомы "курчавости листьев", при которых края листьев закручиваются вниз, листья становятся хрупкими и ломкими при прикосновении и похрустывают при легком надавливании. Растения сортов Сеянец Бомфорта "В", Моллинг Энтерпрайз, Моллинг Джуел, Моллинг Нотейбл, Норфолк Джайент и Прусская образуют карликовые, ломкие побеги и обычно отмирают в течение двух лет после появления симптомов на листьях. Зараженные растения других сортов обычно менее мощные, чем здоровые растения, но не отмирают и часто проявляют слабые симптомы на листьях или совсем их не образуют.
2. ВЧКПТ. Этот вирус развивает симптомы, сходные с симптомами, вызываемыми у менее чувствительных сортов вирусом кольцевой пятнистости малины (ВКПМ). Два из сортов, приведенных в таблице 9, восприимчивы к обоим вирусам. Один из них, сорт Норфолк Джайент, развивает симптомы курчавости листьев, если заражен любым из этих двух вирусов, но в противном случае слабо заражается вирусом' ВЧКПТ, в то время как ВКПМ вызывает летальное заболевание. На другом сорте Моллинг Эксплойт развиваются слабые симптомы кольцевой пятнистости при заражении любым из этих двух вирусов (рис. 76, внизу).
б) Другие растения-хозяева. О симптомах, вызываемых этими вирусами на других ягодных культурах, см. части 1, 2 и 4 настоящего справочника.
ВКПМ в сочетании с вирусами типа некротической кольцевой пятнистости Prunus вызывает симптомы бородавчатости листьев на черешне [80, 189]. Симптомы, вызываемые ВЧКПТ на других культурах, уже описывались различными авторами на сахарной свекле [113], сельдерее [131], салате [216], луке-порее и луке [56], картофеле [104, 118], брюкве и турнепсе [113], томате [214].
![Рис. 76. Вверху - лист красной малины сорта Моллинг Джуел, пораженный кольцевой пятнистостью малины; внизу - лист красной малины сорта Моллинг Зксплойт, пораженного вирусом черной кольцевой пятнистости томата [238]](pic/000083.jpg)
Рис. 76. Вверху - лист красной малины сорта Моллинг Джуел, пораженный кольцевой пятнистостью малины; внизу - лист красной малины сорта Моллинг Зксплойт, пораженного вирусом черной кольцевой пятнистости томата [238]
в) На растениях-индикаторах. Симптомы, вызываевые ВКПМ и ВЧКПТ на некоторых полезных для диагностики растениях-хозяевах, приведены в таблице 10 (см. стр. 228) вместе с симптомами, которые вызываются другими изометрическими вирусами, переносимыми нематодами, обнаруженными на Rubus, Nicotiana clevelandii Gray и Petunia hybrida Vilm, пригодных в качестве хозяев для размножения обоих вирусов. Изоляты значительно различаются по вирулентности, а некоторые изоляты ВКПМ заражают многие виды бессимптомно. Однако на Chenopodiam amaranticolor и С. quinoa всегда развиваются симптомы. Большинство растений-хозяев проявляет более слабые симптомы летом, чем зимой.
Возбудитель. Вирус кольцевой пятнистости малины Г 38 1121 или вирус черной кольцевой пятнистости томата (ВЧКПТ) [214]. Эти оба вируса, переносимые нематодами, имеют полиэдрические частицы (НЕПО-вирусы) диаметром примерно 30 ммк. Некоторые свойства этих вирусов приведены в таблице 11 (см. стр. 233).
Серологические взаимоотношения между ВЧКПТ и ВКПМ не определялись, но встречаются серологически разные= формы каждого вируса. Так, например, шотландский штамм ВЧКПТ (= кольцевой пятнистости свеклы) является антигенно сходным с изолятом вируса псевдоаукубы картофеля из ФРГ [15] и изолятом из лука и лука-порея в Неверной Ирландии [56]. Однако эти изоляты серей логически отличаются от английского типа штамма ( = кольцевой пятнистости салата) и немецкого изолята вируса букетной болезни картофеля, которые очень сходны между собой [115]. Изоляты ВКПМ из ФРГ и Англии сходны, но оба имеют отдаленное родство с шотландским штаммом [43]. Форма ВКПМ, вызывающая болезнь ложковидности листьев красной смородины в Нидерландах, по антигенным свойствам подобна шотландской форме [119, 169].
Передача. а) Различные способы. Оба вируса передаются прививкой, инокуляцией сока и видами нематод рода Longidorus. Они могут проникать через мужские и женские гаметы в семена, а отсюда потомству сеянцев.
Передача вирусов инокуляцией сока с малины на травянистые растения значительно облегчается, если в дополнение к обычному абразиву вносится 2%-ный раствор никотина с буффером рН 8,5 или порошок алюминия добавляется к инокулюму, чтобы предотвратить выпадение танинов, ингибирующих инфекцию. Передача соком с травянистых растений на малину крайне затруднена.
Листер [163] и Листер и Мурант [165] показали, что оба вируса передаются через семена у широкого круга растений-хозяев, включая Rubus, Fragaria и многие виды сорняков. Они обычно не проявляют симптомы в инфицированном потомстве сеянцев. На землянике и малине вирусы передаются семенам и через пыльцу, и через семяпочки, но на малине присутствие конкурирующей здоровой пыльцы сильно снижает способность пыльцы больных растений к завязыванию семян.
Поэтому передача через пыльцу может .иметь небольшое значение в природе. По-видимому, здоровые материнские растения не заражаются, когда их цветки опыляются пыльцой с инфицированных растений.
б) Нематоды. Виды нематод, которые участвуют в качестве переносчиков ВКПМ и ВЧКПТ, приведены в таблице 12 (см. стр. 234). Поскольку они являются обычными переносчиками (Longidorus elongatus de Man), шотландские формы ВКПМ и ВЧКПТ часто встречаются вместе на одной и той же зараженной площади. В противоположность этому, L. attenuatus Hooper и L. macroscma (Hooper), переносчики английских форм ВЧКПТ и ВКПМ, предпочитают различные типы почв, и поэтому переносимые ими вирусы имеют тенденцию встречаться раздельно. Ни тот, ни другой вирус не проникает через яйца L. elongatus, и, по-видимому, маловероятно, чтобы они сохранились после линьки [233]. Мало известно о минимальном сроке приобретения вируса и продолжительности питания, необходимых для заражения, или какой из вирусов имеет латентный период в переносчике. Нематода Longidorus elongatus на черном пару сохраняет инфекционность ВКПМ и ВЧКПТ только около девяти недель [181]. Как личинки, так и взрослые особи L. elongatus могут переносить оба вируса [233; Тейлор, не опубликовано].
Распространение в естественных условиях. Внутри зараженного участка вирусы распространяются нематодами-переносчиками. Однако последние не выживают в воздушно-сухой почве, и маловероятно, чтобы они эффективно переносили ВКПМ и ВЧКПТ на большие расстояния. Наблюдается слабая миграция переносчика в сторону от очага, и заражение идет медленно. Поэтому эти вирусы, вероятно, рассеиваются в природных условиях посредством зараженных семян сорняков и культурных растений [163, 165, 181]. Листер, так же как и Мурант и Тейлор [182], показал, что поскольку вирусы сохраняются в переносчике L. elongatus в течение лишь нескольких недель, то зараженные семена сорняков являются постоянным источником вирусов в почве, давая им возможность выжить во время нахождения почвы под паром или при голодании переносчика.
Вирусы могут также распространяться с зараженным посадочным материалом, особенно из-за слабого проявления симптомов или их отсутствия в начальных стадиях заражения. Это имеет большое значение для международного карантина, так как, хотя по меньшей мере один вид переносчика (L. elongatus) широко распространен во всем мире, не было сообщений об этих вирусах вне пределов Европы. Поэтому правилами инспекции и сертификации посадочного материала малины должна быть еще до посадки предусмотрена проверка почвы на присутствие нематод-переносчиков в дополнение к обследованию растений по симптомам на листьях.
Меры борьбы. а) Применение высококачественного, свободного от вирусов посадочного материала.
б) Использование иммунных сортов. Если вспышка небольшая, следует удалять только больные растения, заменяя их растениями иммунного сорта.
в) Борьба с нематодами-переносчиками путем обработки почвы. Введение в почву препарата ДД (дихлорпропен-дихлорпропан) от 224 до 448 кг/га или применение дуста квинтозена (пентахлорнитро-бензол) в дозе 67 кг/га действующего вещества было успешным как в опыте с земляникой [182, 235 и не опубликовано], так и на промышленной плантации земляники и в насаждениях малины сорта Моллинг Джуел в Восточной Шотландии. Однако квинтозен, который долгое время сохраняется в почве, может повреждать по меньшей мере один сорт малины (Ллойд Джордж) и поэтому должен применяться с осторожностью, пока не будет испытана его безопасность для выращиваемого сорта. Практика измельчения старых побегов малины и возвращения их в почву также полезна для снижения численности L. elongatus [236].
д) Агротехнические методы. Хотя широкий круг хозяев нематод и вирусов делает невозможным использование севооборота как единственной меры борьбы, но не все растения являются одинаково хорошими хозяевами для нематод. Так, например, популяции L. elongatus быстро увеличиваются на землянике, райграсе (Lolium регеппе) и Stellaria media, но уменьшаются на малине [234]. Все эти виды служат хозяевами одного или обоих вирусов. Поэтому в местах, где ВЧКПТ и ВКПМ известны как трудно искореняемые патогены, малину не следует высаживать после земляники или злаковых трав и должна быть обеспечена хорошая борьба с сорняками. Другой довод в пользу хорошей борьбы с сорняками - предотвращение накопления в почве зараженных семян сорняков, которые служат источником вирусов.
Терапия. Имеется немного сведений. В одном опыте обработка в течение трех недель при 37°С не искоренила ВКПМ в растениях малины сорта Моллинг Промис (Чамберс; не опубликовано).
Обнаружение и идентификация. Очаговость в распределении заражения, симптомы кольцевой пятнистости на листьях, склонность к увяданию в середине лета и высокая чувствительность сортов к ВКПМ, карликовые, ломкие побеги, отмершие и отмирающие растения - все это характерные признаки заражения данными вирусами.
Идентификацию присутствующего вируса (вирусов) проводят инокуляцией сока на травянистые индикаторные растения-хозяева с последующей серологической проверкой (например, тесты с инфекционным соком из растений Chenopodiam quinoa или Nicotiana clevelandii]. Серологические тесты необходимы, так как реакции индикаторных растений недостаточно отчетливы.
ЖЕЛТАЯ КАРЛИКОВОСТЬ МАЛИНЫ (RASPBERRY YELLOW DWARF)
Синонимы. Нет. (Сокращенно AMV.)
История и географическое распространение. Название "желтая карликовость малины" было даноХаррисоном [116] болезни малины (Rubus idaeus) сорта Моллинг Зксплойт, вызываемой вирусом, передающимся соком и через почву. Этот вирус был обнаружен также на многих других растениях, включая куманику (Rubus fruticosus agg.). Кадмен [43] показал, что вирус близкородствен вирусу мозаики резухи (AMV), описанной Смитом и Маркхамом [215]. Нематода Xiphinetna diversicaudatam (Micoletsky) служит главным переносчиком [118, 147].
Вирус мозаики резухи, имеющей широкий круг хозяев, сильно распространен в Англии и континентальной Европе, но только недавно был обнаружен в Шотландии [239]. Хотя нематода X. diversicaudatum встречается в Европе и Северной Америке, о AMV не было сообщений за пределами Европы. На малине вирус мозаики резухи обнаружен в Англии, Шотландии, Северной Ирландии, ГДР.
Экономическое значение. Болезнь имеет локальное значение в Англии, но редко встречается в Шотландии, где выращивается большая часть малины в Англии. Если вспышка велика, потери урожая могут быть значительными, так как больные растения дают низкий урожай ягод или совсем их не образуют. Поскольку в начальной стадии заражения симптомы слабо выражены или отсутствуют, вирус может оказаться распространенным с больным посадочным материалом; это может привести не только к потерям среди больного посадочного материала, но и к заражению почвы, если переносчик-нематода уже находится там.
Круг растений-хозяев. Кроме перечисленных видов ягодных культур родов Fragaria, Ribes, Rubus и Vitis, вирус мозаики резухи (BMP) обнаружен в естественных условиях на широком ряде растений-хозяев, приведенных ниже.
Культурные растения. Apium graveolens L. var. dulce (сельдерей), Armoracia rusticana Gaertn., Mey et Scherb. (хрен), Cucumis satiuus L. (огурец), Cururbita pepo L. (кабачки), Forsythia sp., Humalus lupulus L. (хмель), Ligustrum vulgare L. (бирючина), Melilotus officinalis (L.) Lam. (донник), Narcissus spp., Phaseolus multuflorus Willd. (фасоль огненно-красная), Prunus avium L. (черешня), Rheum rhaponticam L. (ревень), Trifolium repens L. (клевер белый).
Дикие растения. Anagallis arvensis L., Arabis hirsuta (L.) Scop., Bellis perennis L., Capsella bursa-pastor is (L.) Medic., Plantago lanceolata L., Polygonum aviculare L., P. persicaria L., Ranunculus repens L., Sambucus nigra L., Senecio vulgaris L., Stellaria media (L.) Cyrill., Urtica urens L.
Почти все обычно используемые травянистые тест-растения чувствительны к местной или системной инфекции BMP, возникающей после инокуляции сока [19].
В опытах по передаче прививкой с сортами малины [45] только сорт Моллинг Зксплойт заражался BMP (см. табл. 9), но несколько других сортов оказались естественно зараженными в Шотландии [239], и, возможно, как в случае с ВКПМ, есть ш гаммы вируса с различной способностью заражать отдельные сорта малины.
Симптомы. а) На малине. Вспышки болезни встречаются пятнами, отражая распространение переносчика в почве. Зараженные растения сорта Моллинг Эксплойт проявляют симптомы болезни на 2 - 3-й год после посадки; молодые побеги останавливаются в росте и дают немного ягод или совсем их не образуют. Симптомы на листьях состоят из небольших желтых пятен (рис. 77, слева), или, обычно на нижних листьях больных побегов, появляются заметные симптомы пожелтения жилок или желтой сетчатости (рис. 77, справа).
б) На других культурах. Симптомы, вызываемые BMP на землянике, описаны выше (см. стр. 65). Симптомы на некоторых других культурах были описаны несколькими авторами: на огненно-красной фасоли, сельдерее, клевере белом и кабачках [122]; черешне [80]; огурцах [129]; хмеле [19].
в) На индикаторных растениях-хозяевах. Симптомы, вызываемые BMP на некоторых диагностических растениях-хозяевах, приведены в таблице 10 (см. стр. 228). Штаммы вируса различаются по вирулентности, и многие виды растений-хозяев образуют более слабые симптомы летом, чем зимой. Nicotiana clevelandii Gray и Petunia hybrida Vilm. являются подходящими хозяевами для размножения этого вируса.

Рис. 77. Листья малины сорта Моллииг Эксплойт, пораженного желтой карликовостью, возбудителем которой является штамм вируса мозаики резухи. Показаны два типа симптомов
Характеристика вируса. Вирус мозаики резухи передается нематодами; частицы вируса полиэдрические (НЕПО-вирус), приблизительно 30 ммк в диаметре. Некоторые физические свойства вируса приведены в таблице 11 (см. стр. 233).
BMP имеет общие антигены с вирусами папоротниковидности и желтой мозаики винограда, но они отличаются от BMP во многих отношениях [53] (см. стр. 323). Форма BMP из хмеля также серологически отличима от типичного штамма [19].
Передача. а) Различные способы. BMP передается прививкой, инокуляцией сока ,и видами нематод рода Xiphinema. Вирус может также проникать в семена и заражать потомство сеянцев. Передача соком с растений Rubus на травянистые хозяева облегчается, если к обычному абразиву добавить 2%-ный раствор никотина, буфер рН 8,5, или порошок алюминия к инокулюму, чтобы предотвратить ингибирующее действие танинов на инфекцию. Передача соком с травянистых растений на Rubus не испытывалась. Вирус переносится семенами многих видов растений-хозяев обычно без проявления симптомов у зараженных таким путем сеянцев [163, 165], но передача семенами у Rubus пока еще не доказана.
б) Нематоды. BMP передается нематодами рода Xiphinema (см. табл. 12 стр. 234). Как BMP, так и вирус латентной кольцевой пятнистости земляники (ВЛКПЗ) передаются нематодами X. diver-sicaudatum, поэтому эти два вируса часто встречаются вместе. Мало известно о взаимоотношениях вирус - переносчик. Джха и Поснетт [148] установили, что нематода Ar. diver sic audat am могла приобрести вирус после питания в течение одного дня на больном растении и вирофорные нематоды могли заразить приманочные растения после питания на них в течение 3 дней. Вирус мозаики резухи, вероятно, не передается через яйцо и не сохраняется во время линьки нематоды. В противоположность вирусам кольцевой пятнистости малины и черной кольцевой пятнистости томата, переносимых нематодой Longidorus elongatus, BMP и родственные ему вирусы сохраняются в своих переносчиках в течение длительного периода. Так, например, X. diver sicaudatum передавала вирус мозаики резухи через 31 день, когда содержалась на черном пару [148], а Харрисон и Уинслоу [122] нашли, что она была еще способна передавать вирус мозаики резухи после питания в течение 8 месяцев на иммунном к вирусу сорте малины. Как в стадии личинки, так и во взрослом состоянии нематоды могут переносить вирус.
Распространение в естественных условиях. В пределах зараженных участков BMP разносится нематодой Xiphinema diversicauda-turn. Однако маловероятно, чтобы распространение BMP на дальние расстояния проходило с помощью нематод-переносчиков, которые не выживают в воздушно-сухой почве. Кроме того, миграция в сторону соседних участков незначительна, и инфекция распространяется медленно. Поэтому вирус, вероятно, распространяется зараженными семенами сорняков и культурных растений, подобно вирусам кольцевой пятнистости малины и черной кольцевой пятнистости томата [163, 165, 181]. Однако наличие зараженных семян сорняков в почвах имеет меньше значения для BMP, чем для менее стойких вирусов кольцевой пятнистости малины и черной кольцевой пятнистости томата, так как BMP сохраняется в течение длительного периода в нематодах-переносчиках. Действительно, почва зараженных участков содержала сравнительно немного инфицированных семян сорняков [181]. BMP может также распространяться с зараженным посадочным материалом, особенно из-за слабого развития или даже отсутствия симптомов на ранних стадиях заражения. Это имеет большое значение при соблюдении международного карантина, так как, хотя X. diver sicaudatum широко распространена, о BMP не сообщалось за пределами Европы. Поэтому правилами инспекции и сертификации посадочного материала малины должна быть предусмотрена проверка почвы до посадки на присутствие нематод-переносчиков в дополнение к последнему обследованию растений по симптомам на листьях.
Меры борьбы. 1) Использование высококачественного, свободного от вирусов посадочного материала.
2) Использование иммунных сортов (см. стр. 219). Если вспышка небольшая, то только пораженные растения следует заменить растениями иммунного сорта.
3) с нематодами-переносчиками с помощью обработки почвы. Экспериментально препарат ДД (дихлорпропен-дихлорпропан) или метилбромид, каждый из расчета приблизительно 900 кг/га, успешно предотвращали распространение BMP от зараженной земляники [124]; подобные обработки теперь применяются в промышленном масштабе.
Терапия. Сведений о растениях Rubus нет.
Обнаружение и идентификация. Распространение болезни очагами; карликовые побеги и желтые пятна или пожелтение жилок на листьях являются характерными симптомами. Идентификацию проводят путем передачи соком на травянистых индикаторных хозяев с последующими серологическими тестами (например, тесты с инфекционным соком из растений Chenopodium quinoa или Nicotiana clevelandii). Серологические тесты необходимы, так как реакции индикаторных растений недостаточно отчетливы.
ВИРУС ЛАТЕНТНОЙ КОЛЬЦЕВОЙ ПЯТНИСТОСТИ ЗЕМЛЯНИКИ НА РАСТЕНИЯХ RUBUS
Синонимы: Нет. (Сокращенно SLRV.) Нет заболевания растений Rubus, которое связано специфично с этим вирусом.
История и географическое распространение. Вирус латентной кольцевой пятнистости земляники (ВЛКПЗ) был впервые описан Листером [164], который обнаружил его на некоторых видах, включая красную малину (Rubus idaeus L.). Он часто встречается в сочетании с вирусом мозаики резухи, который имеет переносчика-нематоду Xiphinema diversicaudatum. ВЛКПЗ может встречаться широко; его переносчик широко распространен в Европе и Северной Америке, и вирус обнаружен в Англии, Шотландии, Северной Ирландии, ГДР и Швейцарии, но не за пределами Европы. На малине он найден в Северной Ирландии [164] и Шотландии.
Экономическое значение. Не известно.
Круг растений-хозяев. Кроме ягодных культур родов Fragaria, Ribes и Rubus, ВЛКПЗ встречается в естественных условиях на следующих видах: Apium graveolens L. var.dulceMill. (сельдерей), Euonymus еигораеа L. (бересклет), Mentha arvensis L., Narcissus spp., Prunus avium L. (черешня), P. domestica L. (слива), Rheum rhaponticum L. (ревень), Rosa sp. (роза), Sambucus nigra L. (бузина), Stellaria media (L.) Curill. и Trifolium repens L. (клевер белый).
На красной малине ВЛКПЗ обнаружен на сортах Моллинг Эксплойт и Моллинг Джуел.
В опытах по передаче с использованием нематоды в качестве переносчика ВЛКПЗ заражал Cucumis sativus L. (огурец), Petunia hybrida Vilm., Pisum sativum L. (горох) и Spinacia oleracea L. (шпинат). Широкий круг стандартных травянистых тест-растений восприимчив к локальной или системной инфекции, вызываемой инокуляцией сока.
Симптомы. Несколько зараженных ВЛКПЗ растений малины (сорт Моллинг Эксплойт), которые были свободны от одновременного заражения BMP, были бессимптомны; растения, содержащие оба вируса, были сходны по внешнему виду с растениями, содержавшими только один вирус мозаики резухи (рис. 78). Симптомы, вызываемые заражением ВЛКПЗ на других растениях-хозяевах, не были описаны.
Симптомы, вызываемые ВЛКПЗ на некоторых пригодных для диагностики растениях-хозяевах, приведены в таблице 10 вместе с симптомами, которые проявляются в результате поражения другими НЕПО-вирусами, найденными на растениях Rubus. ВЛКПЗ отличается от других НЕПО-вирусов по заражению многих видов, перечисленных как бессимптомных. Изоляты сильно различаются по вирулентности, и симптомы часто более слабые летом. Огурец - благоприятный хозяин для размножения вируса.
Характеристика вируса. Вирус латентной кольцевой пятнистости земляники [164] переносится нематодой; вирусные частицы полиэдрические (НЕПО-вирус), диаметром примерно 26 ммк. Некоторые физические свойства вируса приведены в таблице 11 (см. стр. 233).

Рис. 78. Симптомы поражения вирусами мозаики резухи и латентной кольцевой пятнистости земляники на листе красной малины сорта Моллинг Эксплойт
Передача. Передача соком с растений Rubus на травянистые растения-хозяева облегчается, если к обычному абразиву в инокулюм добавляется 2%-ный раствор никотина, буфер рН 8,5, или алюминиевый порошок, чтобы предупредить ингибирование инфекции танинами. Передача соком с травянистых хозяев на Rubus не предпринималась.
Вместе с BMP ВЛКПЗ передается нематодой Xiphinema diversicaudatum (см. табл. 12). Поэтому оба вируса склонны находиться вместе на одной и той же зараженной площади. Имеется мало сведений о ВЛКПЗ в отношении взаимосвязи вирус - переносчик, за исключением того, что нематоды-переносчики остаются еще инфекционными после месяца пребывания в почве черного пара, и как личинки, так и взрослые нематоды могут переносить вирус (Б. Харрисон, персональное сообщение).
Распространение в естественных условиях. Внутри зараженной площади ВЛКПЗ распространяется нематодой X. diversicaudatum. На большие расстояния вирус распространяется, вероятно, таким же путем, как и вирус мозаики резухи, но нет данных, полученных экспериментально.
Меры борьбы. Способы борьбы, которые эффективны против вируса мозаики резухи, по-видимому, будут также приемлемы против ВЛКПЗ.
Терапия. Доступная информация в отношении рода Rubus отсутствует.
Обнаружение и идентификация. ВЛКПЗ, если он встречается один, не вызывает симптомов на малине сорта Моллинг Эксплойт или на многих травянистых тест-растениях, которые он заражает.
Симптомы на растениях сорта Моллинг Эксплойт, содержащих как ВЛКПЗ, так и вирус BMP, сходны с симптомами на растениях, которые заражены только BMP. Идентификация с помощью серологических тестов всегда необходима (например, тесты с диффузией в геле при использовании инфицированного сока из растений Chenopodium quinoa).
АМЕРИКАНСКАЯ КОЛЬЦЕВАЯ ПЯТНИСТОСТЬ КРАСНОЙ МАЛИНЫ (AMERICAN RED RASPBERRY RINGSPOT)
Синонимы (сокращенно TomRSV.) Yellow blotch-curl (?) [59]; raspberry decline (?) [268a]; blackberry mosaic (?) (частично) [2].
История и географическое распространение. Некоторые авторы уже описывали вирусные болезни типа кольцевой пятнистости на растениях Rubus в Северной Америке. Чемберлен [59] дал название "желтопятнистая курчавость" болезни красной малины сорта Кутберт (R. idaeus) в Онтарио, в то время как Целлер и Браун [268а] сообщали о подобном заболевании из Орегона, которое они назвали "усыхание малины". Воган и др. [249] описали кольцевую пятнистость на нескольких сортах красной малины в штатах Орегон и Вашингтон. Алкорн и др. [2] сообщили о мозаике ежевики (R. procerus) сорта Гималайя, возможно, вызываемой комплексом вирусов. Вирус передавался прививкой этих растений на красную малину, вызывая хлоротичные кольца и пятна, и на персик, вызывая симптомы, подобные тем, которые возникают при поражении вирусом пожелтения почек персика [241], который переносится нематодой. Карл [154] выделил переносимые соком вирусы с растений красной малины и ежевики сорта Гималайя в Калифорнии, которые по кругу растений-хозяев и симптомологически были сходны со штаммами вируса пожелтения почек персика. Кадмен и Листер [52] доказали тесную серологическую взаимосвязь между вирусами пожелтения почек персика (ВППП) и кольцевой пятнистости томата (ВКПТ) [132, 192]. Вскоре после этого вирус с сорта малины Уилламетт в Британской Колумбии, вызывающий болезнь, названную кольцевой пятнистостью красной малины, был идентифицирован по симптомам, перекрестной защите и серологическим тестам как ВКПТ [227, 228]. Возможно, этот вирус был причиной других болезней красной малины типа кольцевых пят-нистостей, упоминавшихся выше. Поэтому американская кольцевая пятнистость красной малины этиологически отлична от кольцевой пятнистости малины, обнаруженной в Европе.
Вирус кольцевой пятнистости томата (ВКПТ), встречающийся на различных растениях-хозяевах, широко распространен в Северной Америке вместе с его переносчиком нематодой Xiphinema аmericanum Cobb. На красной малине он идентифицирован в штатах
Британская Колумбия и Вашингтон [227 и не опубликованные данные], в Онтарио (У. Аллен, персональное сообщение), Мэриленде, Нью-Йорке, Пенсильвании и Западной Виргинии (Конверс и Эндо; не опубликовано). Этот вирус не обнаружен вне Северной Америки, хотя нематоды группы X. americanum встречаются во всем мире. Однако Лима [162] различал 7 видов внутри этой группы, и не известно, как широко распространены формы, способные переносить вирус кольцевой пятнистости томата.
Кроме американской кольцевой пятнистости красной малины, ВКПТ целиком или частично может вызвать болезни других культурных растений, включая курчавость листьев черешни [176], мозаику вяза [55, 247], пожелтение жилок винограда [106], пожелтение почек персика [52], мозаику розы [107] и кольцевую пятнистость томата [204].
Экономическое значение. Болезнь является серьезной на некоторых сортах (Фримен и Стейс-Смит, не опубликовано; Конверс и Скот, не опубликовано).
Круг растений-хозяев. ВКПТ имеет широкий круг естественных хозяев, включая растения, которые причисляются в дополнение к ягодным культурам родов Fragaria, Ribes, Rubus и Vitis (см. части 1, 2, 4 настоящего справочника).
Dipsacus fullonum L. (ворсянка); Erigeron glaucus Ker. (мелколепестник); Gladiolus sp.; Hydrangea macrophylla (Thunb.) DC. (гортензия); Mains sylvestris Mill, (яблоня); Lycopersicum esculentum Mill, (томат); Malva parviflora L.; Picris echioides L.; Plantago sp.; Prunus amygdalus Batsch (миндаль); P. armenica L. (абрикос); P. aviutn L. (черешня); Р. domestica L. (слива); Р. persica Batsch (персик); Rosa sp. (роза); Ulmus americana L. (вяз).
В опытах по передаче с помощью нематод-переносчиков ВКПТ заражал также тест-растения огурца. Почти все обычно используемые травянистые тест-растения восприимчивы к локальному или системному заражению путем инокуляции сока.
Опыты по передаче прививкой показали, что, кроме сорта Уилламетт, к ВКПТ восприимчивы сорта малины Фэйрвью, Ньюбург и Самнер (Стейс-Смит, не опубликовано).
Серологическими тестами ВКПТ выявлен в полевых коллекциях сортов красной малины Кенби, Хилтон, Латам и Тейлор в восточных штатах США (Конверс и Эндо, не опубликовано).
Если все заболевания типа североамериканской кольцевой пятнистости, описанные в литературе, были вызваны ВКПТ, могли быть также заражены следующие сорта: Чиф, Кутберт, Герберт, Ллойд Джордж, Тахома, Викинг, Вашингтон № 324.
![Рис. 79. Два типа симптомов на листьях малины сорта Уилламетт, зараженного вирусом кольцевой пятнистости томата [227]](pic/000086.jpg)
Рис. 79. Два типа симптомов на листьях малины сорта Уилламетт, зараженного вирусом кольцевой пятнистости томата [227]
Симптомы. а) Красная малина. На сорте Уилламетт, зараженном ВКПТ, хлоротичные кольцевые пятна (рис. 79, вверху) появляются на молодых распускающихся листьях новых побегов, но на листьях плодоносящих побегов они слабые или отсутствуют; они не обязательно встречаются на всех побегах больных растений. Кроме того, могут быть менее заметные хлоротичные пятна или сетчатоподобный хлороз вдоль жилок (рис. 79, внизу). Симптомы к середине лета исчезают. За исключением симптомов на листьях, больные растения сорта Уилламетт неотличимы от здоровых растений. Сходные симптомы образуются на сортах Ньюбург и Самнер (Стейс-Смит, не опубликовано). Однако болезнь "желтая пятнистая курчавость" [59], которая, возможно, вызывается ВКПТ, приводит к сильной карликовости и потере мощности у сорта Кутберт; другие сорта, на которые болезнь была передана прививкой, различались по своей чувствительности к инфекции. На сорте Хилтон ВКПТ связан с резкой рассыпчатостью ягод (Кон-вере и Скотт, не опубликовано), б) Ежевика сорта Гималайя. Мозаичная болезнь ежевики (Rubus procerus) сорта Гималайя, описанная Алкорном и др. [2], может вызываться, по крайней мере частично, ВКПТ и характеризуется хлоротичными пятнами и точками, жилковым хлорозом или "дуболистным" рисунком на листьях. Наблюдались слабая деформация и уменьшение размера и числа листочков. Растения со временем погибали.
При прививке на сеянцы персика развивались симптомы, подобные вызываемым ВППП. Однако это может быть обусловлено не только одним вирусом. В опытах по прививке некоторые формы ежевики развивали жилковый хлороз ("перистая жилка") и "дуболистный" узор, но хлоротичные кольца и точки отсутствовали. Эти растения не образовывали симптомов, подобных симптомам вируса пожелтения почек персика, если прививались на персик.
в) Другие культурные растения-хозяева. Симптомы, вызываемые ВКПТ на других ягодных культурах, описаны в частях 1, 2, 4 настоящего справочника. Симптомы некоторых других болезней культур, вызываемые частично или целиком ВКПТ, уже описывались разными авторами: на черешне (бороздчатость) [176]; на вязе (мозаика вяза) [23]; гортензии [27]; персике (пожелтение почек персика), миндале и абрикосе [241]; томате [204].
г) На индикаторных растениях-хозяевах. Из широкого круга восприимчивых к заражению травянистых тест-растений в таблице 10 приведены наиболее важные из них для диагностики, а также развивающиеся на них симптомы.
Характеристика вируса. Вирус кольцевой пятнистости томата передается нематодой, частицы вируса полиэдрические (НЕПО-вирус), примерно 27 ммк в диаметре. Некоторые свойства этого и других НЕПО-вирусов, поражающих сорта Rubus, представлены в таблице 11.
Кадмен и Листер [52] показали, что изоляты вируса пожелтения почек персика и ВКПТ серологически были очень сходны. Однако изолят вируса пожелтения жилок винограда, показанный Гудин-гом [106], как штамм ВКПТ, был серологически отличным, хотя степень различия не была показана. О детальном серологическом изучении изолята из малины не сообщалось.
Передача. а) Различные способы. ВКПТ переносится прививкой, инокуляцией сока, нематодой Xiphinema americanum и через семена и пыльцу передается потомству некоторых видов хозяев.
Передача инокуляцией сока с растений Rubus на травянистые растения-хозяева значительно облегчается добавлением к обычному абразиву 2%-ного раствора никотина, буфер рН 8,5, или порошка алюминия, что предупреждает ингибирующее действие танинов на инфекцию. Передача соком с травянистых растений на растения Rubus не удавалась.
ВКПТ передается через семена у сои [152], земляники [175] и вяза [26-]. Передача семенам через пыльцу была доказана на вязе [54], но не на землянике. По-видимому, передача через семена характерна для НЕПО-вирусов [165], и ВКПТ, вероятно, окажется способным передаваться через семена у многих видов хозяев.
б) Нематоды. Изоляты ВКПТ и ВППП передаются нематодой Xiphinema americanum (см. табл. 12). Телиц и др. [240] показали, что взрослые особи и все стадии личинок X. americanum могут переносить ВКПТ; они также сообщали об успешной передаче вируса после коротких периодов воспринимающего и инфицирующего питания в течение 1 ч. Латентного периода в переносчике нет, и: вирус не передается через яйцо или после линьки.
Распространение в естественных условиях. Внутри очага поражения ВКПТ распространяется нематодой-переносчиком Aiphmema americanum. Однако X. americanum, подобно другим нематодам-переносчикам растительных вирусов, не выживает в воздушно-сухой почве. На далекие расстояния ВКПТ, вероятно, распространяется более эффективно не переносчиком, а зараженными семенами сорняков и культурных растений и зараженным посадочным материалом. Зараженные семена также могут быть важными в качестве постоянного источника вируса в почве [181].
Меры борьбы. а) Использование сертифицированного, свободного от вируса, посадочного материала.
б) Нематода Xiphinema americanum может быть уничтожена обычными нематоцидами, например препаратом ДД, но нет оценки влияния таких обработок на распространение вируса.
Обнаружение и идентификация. Симптомы кольцевой пятнистости на листьях, сглаживающиеся в середине лета, служат хорошим показателем того, что болезнь вызывается вирусом кольцевой пятнистости, переносимым почвой (вероятно, ВКПТ в Северной Америке). Дальнейшая идентификация состоит в передаче соком на травянистые индикаторные растения, такие, как огурец, с последующей серологической проверкой. Последняя необходима из-за недостаточно отчетливых реакций тест-растений.

Таблица 9. Восприимчивость сортов малины к заражению вирусами ВКПМ, ВЧПТ и BMP*
* Все данные опытов получены по передаче вируса прививкой. ** Мурант, Тейлор и Чамберс (не опубликовано).
*** Растения этих сортов были найдены естественно зараженными английским штаммом ВКПМ [114; Треш, персональное сообщение].
**** Растения этих сортов были найдены естественно зараженными BMP в Шотландии [239 и не опубликованные данные].
+ (плюс) - восприимчивый; - (минус) - иммунный; . (точка) - не проверялся.

Рис. 80. Симптомы на Chenopodium amaranticolor. Вверху слева - местные поражения, вызванные вирусом кольцевой пятнистости малины; вверху справа - системные симптомы, вызываемые вирусом кольцевой пятнистости томата; внизу слева - местные поражения, вызываемые вирусом мозаики резухи; внизу справа - системные симптомы, вызываемые вирусом латентной кольцевой пятнистости земляники
Таблица 10*. Симптомы, образуемые на некоторых травянистых тест-растениях НЕПО-вирусами, обнаруженными на растениях Rubus
Сhenopodium amaranticolor Coste et Reyn.
ВКПМ (вирус кольцевой пятнистости малины): хлоротичные или
некротические местные поражения; несистемные
(рис. 80, вверху слева).
ВЧКПТ и ВКПТ (вирусы черной кольцевой пятнистости томата и кольцевой
пятнистости томата): хлоротичные или некротические местные поражения;
системный некроз или хлоротичная крапчатость (рис. 80, вверху справа).
BMP и ВЛКПЗ (вирусы мозаики резухи и латентной кольцевой пятнистости
земляники): хлоротичные местные поражения (рис. 80, внизу слева); системная
хлоротичная крапчатость (рис. 80, внизу справа).
Chenopodium quinoa Willd.
ВКПМ, ВЧКПТ и ВКПТ: хлоротичные или некротические местные поражения;
системная хлоротичная крапчатость или некроз.
BMP и ВЛКПЗ: хлоротичные местные поражения; системная хлоротичная крапчатость.
Nicotiana rustica L.
ВКПМ и ВЧКПТ: местные хлоротичные или некротические пятна или кольца;
системные кольца и линейный узор с варьирующим числом некрозов (рис. 81,
вверху слева). Листья, развившиеся позже, выглядят нормальными, но содержат вирус.
ВКПТ: местные некротические пятна и кольца (рис. 81, вверху справа);
зимой системные некротические кольца.
BMP: местные некротические пятна и кольца; мало системных симптомов.
ВЛКПЗ: инфекция бессимптомная.
Nicotiana tabacutn L., сорт Уайт Барлей.
ВКПМ: хлоротичные местные поражения (рис. 81, внизу слева). Рассеянные
системные хлоротичные пятна и кольца.
ВЧКПТ: местные некротические пятна и кольца (рис. 81, внизу справа) .
Системные хлоротичные и некротические пятна, кольца и линейный узор
(рис. 82, вверху слева). Листья, развившиеся позже, выглядят нормальными,
но содержат вирус.
ВКПТ: местные некротические пятна. Зимой системная некротизация жилок.
BMP: хлоротичные или некротические местные поражения Некоторые штаммы
вызывают образование желтых пятен, колец и линейного узора с частичным выздоровлением.
ВЛКПЗ: инфекция бессимптомная.
Phaseolus vulgaris L. сорт Принц.
ВКПМ: зимой темно-коричневые некротические местные поражения U,5 мм в диаметре
(рис. 82, вверху справа); летом хлоротичные поражения (или отсутствуют);
системная хлоротичная крапчатость с варьирующим количеством некрозов и
деформацией (рис. 82, внизу слева).
ВЧКПТ: симптомы сходны с симптомами, вызываемыми ВКПМ но местные поражения зимой
крупнее, до 2 мм в диаметре (рис. 82 внизу справа), и инокулированные листья опадают.
ВКПТ: симптомы очень сходны с симптомами, вызываемыми ВЧКПТ но инокулированные
листья не опадают зимой.
BMP: тусклые хлоротичные местные поражения; системный некроз и деформация.
ВЛКПЗ: зимой тусклые хлоротичные местные поражения и системный жилковыи
хлороз; летом бессимптомная инфекция
Petunia hybrida Vilm.
ВКПМ и ВЧКПТ: хлоротичные местные поражения, иногда с коричневыми некротическими
краями (рис. 83, вверху слева). Системный жилковыи хлороз или некроз. При заражении ВЧКПТ
листья, развившиеся позднее бессимптомные, но содержат вирус: при заражении ВКПМ
на листьях образуются длительно сохраняющиеся желтые кольца и линейный узор
(рис. 83, вверху, в центре и справа) в дополнение к бессимптомным листьям.
ВКПТ: местные некротические поражения; системный жилковый некроз (рис. 83, внизу слева).
Листья, развившиеся позднее, могут быть бессимптомными, но содержат вирус.
BMP: местные хлоротичные поражения или некротические кольца. Симптомное посветление
жилок или желтые кольца и линейный узор (рис. 83, внизу справа) Листья, развившиеся
позднее, бессимптомные, но содержат вирус.
ВЛКПЗ: бессимптомная инфекция.
*(Рисунки, на которые даются ссылки в таблице, помещены на стр. 229 - 232 )

Рис. 81. Симптомы на Nicotiana rustica. Вверху слева - системные симптомы, вызываемые вирусом кольцевой пятнистости малины; вверху справа - местные поражения, вызываемые вирусом кольцевой пятнистости томата. Симптомы на N. tabacum сорт Уайт Барлей. Внизу слева - местные поражения, вызванные вирусом кольцевой пятнистости малины; внизу справа - местные поражения, вызванные вирусом черной кольцевой пятнистости томата

Рис. 82. Симптомы на Nicotiana tabacum, сорт Уайт Барлей. Вверху слева - системные симптомы, вызываемые вирусом черной кольцевой пятнистости томата. Симптомы на Phaseolus vulgaris, сорт Принц. Вверху справа - местные поражения (зимняя форма), вызываемые вирусом кольцевой пятнистости малины; внизу слева - системные симптомы, вызываемые вирусом кольцевой пятнистости малины; внизу справа - местные поражения (зимняя форма), вызываемые вирусом черной кольцевой пятнистости томата
![Рис. 83. Симптомы на Petynia hybrida. Вверху слева - местные поражения, вызываемые вирусом черной кольцевой пятнистости томата; вверху в центре и справа - системные симптомы, вызываемые вирусом кольцевой пятнистости томата [114]; внизу слева - системные симптомы, вызываемые вирусом кольцевой пятнистости томата; внизу справа - системные симптомы, вызываемые вирусом мозаики резухи](pic/000091.jpg)
Рис. 83. Симптомы на Petynia hybrida. Вверху слева - местные поражения, вызываемые вирусом черной кольцевой пятнистости томата; вверху в центре и справа - системные симптомы, вызываемые вирусом кольцевой пятнистости томата [114]; внизу слева - системные симптомы, вызываемые вирусом кольцевой пятнистости томата; внизу справа - системные симптомы, вызываемые вирусом мозаики резухи

Таблица 11. Свойства НЕПО-вирусов, обнаруженных на Rubus*
*(Произведенные цифры выборочные, так как они определены в одной лаборатории с использованием стандартных методов и сравнимых тест-растений)
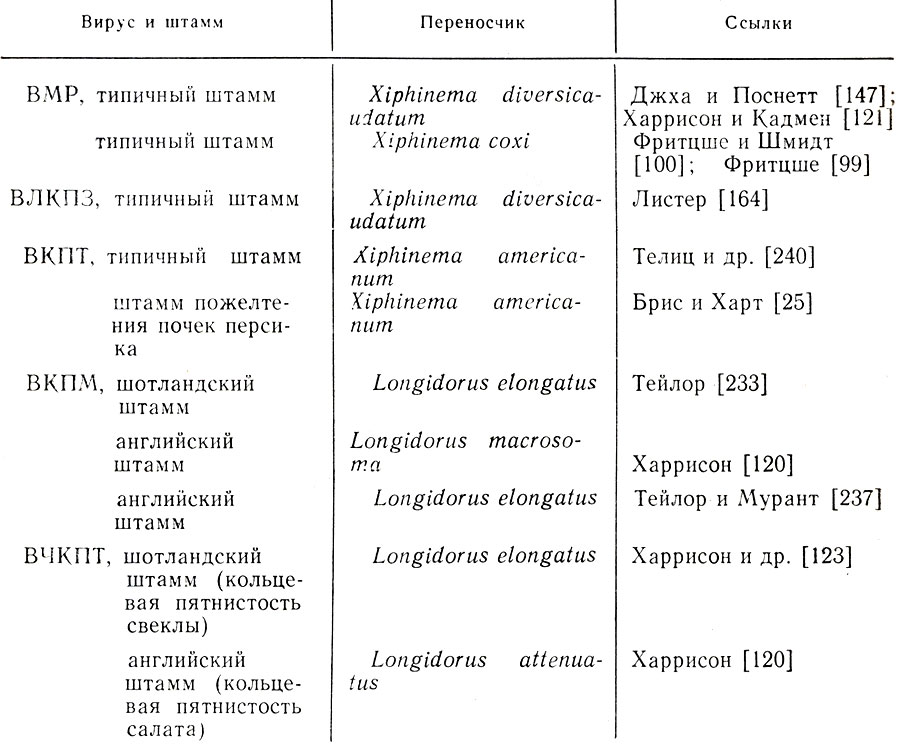
Таблица 12. Нематоды-переносчики НЕПО-вирусов, обнаруженных на Rubus
ВИРУС ХЛОРОТИЧНОЙ ПЯТНИСТОСТИ ЛИСТЬЕВ ЯБЛОНИ НА МАЛИНЕ
Синонимы. (Сокращенно CLSV.) Raspberry bushy dwarf.
История и географическое распространение. Название "кустистая карликовость малины" было использовано Кадменом и Харрисоном [49] для описания заболевания усыхания малины на сорте Ллойд Джордж. Больные растения содержали смесь вирусов, которые, по-видимому, имели общий компонент [35]. Он был позже идентифицирован с вирусом, передаваемым соком [45], который оказался серологически родственным вирусу, вызывающему хлоротичную пятнистость листьев яблони [47, 82, 167]. Хотя этот вирус был соответственно охарактеризован в 1961 г., название "кустистая карликовость малины" считалось неподходящим для вируса, который, вероятно, более широко распространен и больше известен как латентный вирус плодовых. Поэтому лучше назвать его вирусом хлоротичной пятнистости листьев яблони (ВХПЛЯ) и рассматривать в качестве возбудителя болезни кустистой карликовости малины [47].
На малине ВХПЛЯ встречается по всей Англии на сорте Ллойд Джордж; он найден в Нидерландах [45] и, возможно, в Восточной Европе, уже обнаружен на растениях Rubus idaeus и, по-видимому, также на R. occidentalis в Канаде и США (Кадмен и Конверс, не опубликовано).
Экономическое значение. Снижение мощности и урожайности сорта Ллойд Джордж в Англии определенно связано с заражением ВХПЛЯ. Однако предварительные сведения, полученные в полевых опытах, наводят на мысль о том, что собственно сам вирус не оказывает серьезного влияния на энергию роста и урожайность, и возможно, что синдром типичной дегенерации растений является результатом одновременного заражения ВХПЛЯ и различными переносимыми тлями латентными вирусами, к которым сорт Ллойд Джордж очень восприимчив. По-видимому, в Англии Ллойд Джордж является единственным сортом, который сильно страдает от инфекции.
Круг растений-хозяев. a) Rubus. ВХПЛЯ заражает многие сорта красной малины (R. Idaeus), включая Кенби, Комет, Индиан Саммер, Ллойд Джордж, три ист-моллингских сорта (Зксплойт, Ландмарк и Нотейбл), Мальборо, Норфолк Джайент и Викинг. Сорта Моллинг Джуел и Моллинг Промис, возможно, иммунны; растения этих сортов не заражались в опытах с прививкой [35] и не обнаруживались зараженными в естественных условиях.
ВХПЛЯ передавался прививкой на R. henryi и R. occidentalis и был обнаружен на растениях ежевики сорта Каскад из Орегона (Чамберс, не опубликовано). Вирус не обнаружен на других диких или культивируемых видах Rubus.
б) Другие виды розоцветных. Варианты или штаммы ВХПЛЯ, серологически идентичные или близкородственные формам, выделенным из малины, изолированы из миндаля (Prunus amygdalus Batsch), черешни (P. avium L.), сливы (Р. domestica L.), персика (Р. persica Batsch), алычи (Р. cerasifera Ehrh. var. pissardii Koehne), яблони (Malus sylvestris Mill.), груши (Pijrus communis L.) и айвы (Cydonia oblonga Mill.) в Англии [45, 46, 811, Европе [187] и США [166].
в) Травянистые растения. Вирус, серологически родственный ВХПЛЯ, найден в естественно инфицированных растениях Anthriscus sylvestris Hoffm. (кервель) в Англии [180]. Экспериментально ВХПЛЯ заражает ограниченное число видов, которые включают: Beta vulgaris L., Chenopodium amaranticolor Coste et Reyn., C. quinoa Willd., Claytonia (Montia) perfoliata Donn, Cacumis sativus L., Nicotiana clevelandii Gray и N. tabacum L.

Рис. 84. Растение малины сорта Ллойд Джордж, пораженное кустистой карликовостью. К моменту фотографирования растение было высотой 30см
Симптомы. a) Rubus. Из сортов, перечисленных в разделе "круг растений-хозяев", Ллойд Джордж является единственным, который проявляет симптомы, и пока не ясно, зависит ли это от поражения одним ВХПЛЯ или от заражения конкурирующими с ВХПЛЯ и переносимыми тлями латентными вирусами. Побеги на больных растениях короче нормальных и очень склонны к осеннему плодоношению, а развивающиеся на них листья закручиваются вниз и выглядят маслянистыми. Появление молодых побегов весной запаздывает, побеги хлоротичные и часто приобретают красный оттенок (рис. 84). Признаки заболевания глазомерно определить трудно. Все другие восприимчивые сорта являются бессимптомными носителями ВХПЛЯ. В тепличных условиях больные растения черной малины сорта Плам Фармер были карликовыми, но не обнаруживали симптомов на листьях; листья на зараженных растениях Rubus henryi были крапчатыми.
б) Травянистые растения. Симптомы значительно варьируют в зависимости от изолята вируса и времени года. Огурец и виды Nicotiana легко инфицируются только во время зимних месяцев. Два растения-хозяина - Chenopodium amaranticolor и С. qulnoa являются наиболее надежными для диагностики заболевания. На каждом из них изоляты ВХПЛЯ, выделенные из малины, вызывают хлоротичные поражения на инокулированных листьях через 5 - 8 дней после заражения и "дуболистные" и кольцевые узоры на системно зараженных листьях (рис. 85).
Характеристика вируса. ВХПЛЯ имеет нитевидные частицы шириной 12 ммк и неопределенной длины (возможно, порядка 600 ммк) [46, 166]. По строению они очень сходны с частицами вируса желтухи свеклы [136]. Характерные частицы лишь изредка обнаруживались в соке Chenopodium quinoa, инфицированного вирусом, выделенным из малины, но их не находили в соке из больных растений малины. Характерно, что изоляты ВХПЛЯ, выделенные из растений малины, достигают более низкой концентрации в соке растений С. amaranticolor, чем изоляты из яблони и других древесных хозяев. Сок из растения С. amaranticolor теряет инфекционность, если разбавляется более чем 1:200, нагревается в течение 10 мин при температуре около 56°С, хранится при -10°С или содержится более двух дней при 20°С [45]. Изоляты ВХПЛЯ из растений малины отличаются по симптоматологии и более стойкие in vitro, чем изоляты из яблони и других древесных хозяев.

Рис. 85. Слева и в центре - листья Chenopodium quinoa, системно зараженные вирусом хлоротичной пятнистости листьев, выделенным из малины. Справа - лист огурца с тем же типом инфекции
Кадмен [46] обнаружил, что изоляты из растений малины и миндаля серологически были неразличимы и разделялись только по соотношению их антигенных детерминант с изолятами из яблони, черешни, груши, сливы и Prunus cerasifera var. pissardii. Листер и др. [166], используя антисыворотку, приготовленную против высокоочищенных препаратов изолята ВХПЛЯ из яблони, не смогли обнаружить какие-нибудь антигенные различия между изолятами из малины и яблони. Это противоречие, таким образом, пока остается неразрешенным.
Передача. ВХПЛЯ передается прививкой, механической инокуляцией сока с малины на травянистые растения-хозяева и на малину через пыльцу. Передача с травянистых растений-хозяев на малину инокуляцией сока не испытывалась.
Сок из растений малины более инфекционен весной и осенью, чем летом, а инокулюм более инфекционен в любое время, если готовится с использованием алюминия или 2%-ного раствора никотина. Chenopodium quinoa - наиболее восприимчивое растение-хозяин.
Вирус обнаружен в листьях, цветочных частях, пыльце и семенах больных растений малины.
Попытки передать ВХПЛЯ с малины на малину с использованием всех потенциальных насекомых-переносчиков, которые живут на малине, были безуспешными. Нет данных о том, что вирус передается через почву. Однако здоровые растения малины сорта Ллойд Джордж становились системно зараженными ВХПЛЯ иногда уже через 6 недель после того, как их цветки опылялись пыльцой с больных растений. Вирус передается также в высокой степени (40%) через семена больных растений [47]. ВХПЛЯ легко обнаруживается в пыльце больных растений видов Chenopodium, а передача через семена С. quinoa была неэффективной (Кадмен, не опубликовано). Хотя ВХПЛЯ может быть обнаружен в пыльце больных деревьев яблони путем механической передачи на С. quinoa, нет доказательства передачи вируса пыльцой или семенами у яблони.
Распространение в естественных условиях. Быстрое распространение ВХПЛЯ на плантациях малины сорта Ллойд Джордж объясняется эффективностью передачи через пыльцу. На плантации, в начале свободной от вируса, через 4 года от 70 до 80% растений становились зараженными (Кадмен, не опубликовано). Другие восприимчивые сорта, например Норфолк Джайент, Моллинг ;Эксплойт, редко заражались в поле, и заражение трудно удавалось с помощью пыльцы с больных растений. Инфекция первоначально должна распространяться из источников вне культуры; по-видимому, этими источниками являются другие зараженные растения малины, а не растения других родов розоцветных, хотя не было проведено опытов, чтобы исключить их.
Меры борьбы. Очевидно, нет эффективных способов предотвращения распространения ВХПЛЯ на плодоносящих плантациях малины. Однако в питомниках малины удаление цветков до того, как они раскроются, теперь является рекомендуемым приемом, и это должно защитить растения от инфекции, переносимой пыльцой.
Терапия. Зараженные растения малины сорта Ллойд Джордж не были освобождены от вируса, когда они содержались в течение пяти недель при температуре 37°С. Однако разные древесные плодовые культуры освобождались от ВХПЛЯ путем сочетания термотерапии с культурой верхушек побегов [57].
Обнаружение и идентификация. ВХПЛЯ на малине лучше обнаруживается инокуляцией сока на Chenopodium guinea, на котором вирус вызывает характерную деформацию листьев и крапчатость в течение 8 - 10 дней после инокуляции. Серология и (или) электронная микроскопия - наиболее приемлемые методы идентификации, но антисыворотки трудно приготовить и использовать, а изоляты вируса из растений малины имеют слишком низкую концентрацию для обнаружения характерных частиц вируса в соке.
ЛАТЕНТНЫЙ ВИРУС ЧЕРНОЙ МАЛИНЫ (BLACK RASPBERRY LATENT VIRUS)
Синонимы. В обычном употреблении нет. (Сокращенно BRLV.) Название "новый вирус логановой ягоды" было использовано в качестве рабочего термина во время начального изучения [74].
История и географическое распространение. Латентный вирус черной малины (ЛВЧМ) был впервые обнаружен в штате Мэриленд в 1964 г. на нескольких промышленных плантациях черной малины. Заболевание широко распространено на большинстве культурных сортов черной малины, выращиваемых в восточных штатах США, но редко встречается на красной малине. Вирус не обнаружен на ограниченном количестве посадочного материала малины из западных штатов США, обследованных до настоящего времени. Оно было описано Конверсом и Листером [73].
Экономическое значение. Не известно. Была проведена оценка большинства сортов черной малины в восточных штатах США, одинаковых по заболеванию.
Круг растений-хозяев. а) В естественных условиях. Было установлено, что сорта черной малины Блэк Хаук, Бристоль, Камберленд, Моррисон и Нью Логан, так же как и некоторые сорта красной малины из восточных штатов, были заражены.

Рис. 86. Растение Chenopodium quinoa, системно зараженное латентным вирусом черной малины
б) Экспериментально. Chenopodium quinoa Willd. является исключительно ценным хозяином для обнаружения вируса путем механической инокуляции сока больных растений малины, но его трудно перенести с С. quinoa на другие травянистые растения-хозяева. Четыре других испытанных вида Chenopodium были также восприимчивы. Инокулированные растения огурца (Cucumis sativus) пригодны в качестве источника вируса для изучения круга растений-хозяев. Gomphrena globosa L. - хорошее растение-хозяин, в котором сохраняются изоляты ЛВЧМ. Другие испытанные растения, восприимчивые к заражению ЛВЧМ (хотя симптомы проявляются не всегда), перечислены ниже: Amaranthus caudatus L., Atriplex hor-tensis L., Celosia argentea L. var. cristata Kuntze, Hyoscyamus niger L., Momordica balsamina L., Nicotiana glutinosa L., M tabacum L. сорта Турецкий и Ксанти, Petroselinium crispum (Mill.) Mansf., Phaseolus vulgaris L., Spinacia oleracea L., Tetragonia expansa Murr., Torenia fournieri Lindl. и Vigna sinensis (Torner) Savi.

Рис. 87. Вверху - лист огурца, системно инфицированный латентным вирусом черной малины. Внизу - лист турецкого табака, инокулированный тем же вирусом
Симптомы заболевания не развивались на Rubus henryi и Pru-nus serrulata Lindl. (сорт Широфуген) после прививки на них черной малины, зараженной ЛВЧМ. Вирус не передавался с травянистых растений-хозяев обратно на малину.
Симптомы. Симптомы не обнаруживались на растениях-хозяевах рода Rubus. Симптомы на трех представителях травянистых хозяев описываются ниже.
Chenopodium qumoa. Хлоротичные местные поражения на инокулированных листьях становятся некротическими. Затем эти листья искривляются, и появляется системный некроз (рис. 86).
Огурец (Cucumis salivas, сорт Нейшнел Пиклинг). Желтые местные поражения на инокулированных семядолях. Системная крапчатость, посветление жилок, деформация и карликовость (рис. 87, вверху).
Табак (Nicotiana tabacum, сорт Турецкий). Узор из крупных, некротических, разорванных колец на инокулированных листьях без дальнейшего развития симптомов (рис. 87, внизу).
Характеристика вируса. Очищенный ЛВЧМ состоит из трех нуклеопротеидных компонентов, из которых инфекционный компонент имеет коэффициент седиментации, равный примерно 98 S. ЛВЧМ инактивируется осаждением или экстракцией ацетоном, этанолом, бутанолом и сульфатом аммония. Предварительно замороженные зараженные листья или сок отличаются очень низкой инфекционностью. Температура инактивации ЛВЧМ в соке из Chenopodium qumoa равна 46 - 49°С. Длительность сохранения т vitro в соке инфицированного С. quinoa с добавленным антиокислителем составляет более трех и менее пяти дней при 5°С.
Частицы ЛВЧМ изометрические диаметром примерно 30 ммк. Из-за нестойкости в фосфоровольфрамовой кислоте препараты ЛВЧМ, предназначенные для электронной микроскопии, предварительно обрабатывают 1%-ным альдегидом глютаровой кислоты до негативного окрашивания. Вирус, по-видимому, встречается в малых количествах в зараженных растениях огурца или С. quinoa (инфекционный титр равен 1 : 10 - 1 : 1000). Вирус может быть частично очищен и концентрирован путем экстрагирования из сока хлороформом или изменения рН с последующим дифференциальным центрифугированием или центрифугированием в градиенте плотности. Титры вируса до 1 : 10000 могут быть получены путем таких этапов очистки.
ЛВЧМ не реагирует с антисывороткой, приготовленной против вирусов мозаики резухи, кольцевой пятнистости малины, мозаики Chenopodium rubrum, латентной кольцевой пятнистости земляники, некроза табака, черной кольцевой пятнистости томата, малинного штамма вируса кольцевой пятнистости томата, штамма мраморности миндаля вируса кольцевой пятнистости Prunus, карликовости сливы и папоротниковидности листьев черешни. Специфичной антисыворотки к ЛВЧМ еще не получено.
Передача. У малины ЛВЧМ передается через семена [74] у 10% растений двух испытанных сортов черной малины и переносится через пыльцу с зараженных клонов черной малины [71]. Заражение материнских форм растений наблюдалось в некоторых случаях, когда пыльца больных растений черной малины использовалась для опыления здоровых клонов черной малины. Пыльца малины, даже не раздавленная, является превосходным источником инокулюма для заражения травянистых растений. Применение 2%-ного водного раствора никотина облегчает передачу ЛВЧМ с зараженных растений малины на травянистые индикаторные растения. Кроме цветочных частей, очень молодые побеги, которые развиваются весной, служат хорошими источниками инокулюма, но обнаружить ЛВЧМ в зрелых листьях обычно очень трудно.
Хорошим индикаторным растением служит С. quinoa, когда он быстро растет в условиях прохладной теплицы (ниже 25°С).
ЛВЧМ не передавался экспериментально с малины на малину тлей Amphorophora agathonica (?) Hottes в условиях, в которых вирусы мозаики малины легко передавались. Попытки доказать сохранение ЛВЧМ почвой были безуспешными.
Распространение в естественных условиях. Имеются лишь сведения о том, что пыльца может играть важную роль в переносе заболевания; других данных нет. Эта болезнь очень широко распространена на некоторых сортах черной малины, подтверждая тем самым, что должен быть эффективный способ распространения вируса в естественных условиях.
Меры борьбы. Сведений нет.
Терапия. Выдерживание больных растений черной малины при постоянной температуре 37°С в течение 16 дней не уничтожало ЛВЧМ.
Примечания. ЛВЧМ были успешно инокулированы растения, уже зараженные вирусами покраснения узлов фасоли, кольцевой пятнистости Prunus и кольцевой пятнистости томата. На основании изучения круга растений-хозяев, переносчика, серологии и перекрестной защиты было заключено, что ЛВЧМ отличим и не родствен ни с каким из испытанных вирусов [73].
Обнаружение и идентификация. На малине нет отчетливых симптомов, связанных с инфекцией ЛВЧМ. Обнаружение проводят только путем инокуляции соком подходящего индикаторного хозяина, например С. quinoa, системный некроз у которого служит признаком заражения ЛВЧМ. Однако многие вирусы вызывают системную некротизацию С. quinoa. В частности, вирус кольцевой пятнистости томата, который иногда встречается на североамериканских сортах красной малины, также образует идентичные симптомы на С. quinoa.
Поэтому подозрительные на ЛВЧМ культуры должны проверяться с помощью антисыворотки к вирусной кольцевой пятнистости томата или контролироваться путем тестов перекрестной защиты.
Использование молодых хорошо растущих испытуемых растений и тест-растений, выращенных в прохладных условиях, облегчает обнаружение ЛВЧМ.
БОЛЕЗНИ МАЛИНЫ ТИПА ЖЕЛТУХ (YELLOWS DISEASES OF RASPBERRY)
Синонимы. Нет.
История и географическое распространение. Было показано, что болезни такого типа вызываются агентами, переносимыми прививкой, и симптомы описаны Кадменом [34].
Хотя болезни типа желтух обычны для Англии и встречаются на североамериканском сорте Мальборо и в Западной Европе, о них не сообщалось из Северной Америки или других мест, где выращивается малина.
Экономическое значение. Не известно.
Круг растений-хозяев. Болезнь известна только на сортах красной малины (Rubus idaeus L.).
Симптомы. Симптомы варьируют в зависимости от штамма вируса и сорта малины. Типичным является, что симптомы наиболее четко выражены весной. Листья на плодоносящих побегах и первые распустившиеся листья молодых побегов приобретают золотисто-желтую окраску и сохраняют желтоватый отлив в течение всего вегетационного периода. Обычно после начала весны не бывает отчетливых симптомов на листьях молодых побегов.
Некоторые формы желтух характеризуются ярким хлорозом более мелких жилок. Симптомы также более заметны на листьях плодоносящих побегов, но изредка могут обнаруживаться на листьях молодых побегов до середины лета (рис. 88).
Это служит некоторым доказательством [34], что слабые и резкие типы симптомов могут быть вызваны родственными штаммами одного вируса.
Характеристика вируса. Сведений нет.
Передача. Повторные попытки передать вирус с помощью тлей Amphorophora rubi (Kalt.) и Aphis idaei Goot не дали результатов, и насекомое-переносчик не было обнаружено.
Распространение в естественных условиях. Болезни типа желтух быстро распространяются в поле на сорте Ллойд Джордж, но медленнее на других сортах, например на Норфолк Джайент, если они высажены вблизи источника инфекции.
Меры борьбы. Нет сведений.
Терапия. Растения сорта Норфолк Джайент не были освобождены от инфекции, когда выдерживались в течение шести недель при 37°С, поэтому считают, что болезнь вызывается термостойким вирусом [62].

Рис. 88. Слева - симптомы слабого пожелтения на малине сорта Норфолк Джайент; справа - резкие симптомы желтухи на том же сорте
Примечания. Этиология болезней типа желтух недостаточно понята и должна быть заново изучена. Основной помехой в этом является отсутствие подходящего индикаторного хозяина.
Обнаружение и идентификация. Характерные симптомы, которые образуются на сорте Норфолк Джайент при передаче прививкой, служит пока единственным; способом идентификации заболевания.
ПОЛОСАТОСТЬ ЧЕРНОЙ МАЛИНЫ (BLACK RASPBERRY STREAK)
Синонимы. (Сокращенно BRSV.) Raspberry mild streak; raspberry severe streak; raspberry eastern blue-stem; raspberry rosette.
История и географическое распространение. Полосатость черной малины была впервые описана Уилкоксом [253], который дал ей название "восточное посинение стебля", описал симптомы на черной малине и показал, что эта болезнь распространена в полевых условиях Уилкокс не смог установить связи болезни с бактериями или грибами, так же как не смог доказать, что она вызывается вирусом, хотя он считал это вероятным. Позднее название болезни было переименовано на "полосатость" Доджем и Уилкоксом [89]. В настоящее время это заболевание, как описал его Уилкокс в летальной форме на черной малине, в основном является "исторической редкостью". Раньше думали, что болезнь имеет большое значение в северном Огайо, западной Пенсильвании и западном Нью-Йорке. Резкая полосатость была хорошо описана и проиллюстрирована Беннеттом [11].
Ранкин [196] описал слабые и резкие формы полосатости на основе различий в симптомах. Стейс-Смит [223] полагал, что они вызываются штаммами одного вируса. Редкость резкой полосатости, отсутствие точной информации и факт, что наибольшая часть данных бралась из статей, касающихся слабой полосатости, убеждают в том, что болезнь вызывается только одним вирусом - вирусом полосатости черной малины, хотя могут существовать его штаммы, различающиеся по вредоносности. Для ясности штамм, обозначенный данным автором, будет указан в скобках всюду, где это потребуется.
Много сообщений было о заболевании полосатостью черной малины в районах ее выращивания в восточных штатах США, в Орегоне [265] и Онтарио [16]. В настоящее время болезнь имеет небольшое значение и ограничено главным образом штатами Огайо и Нью-Йорк.
Симптомы (слабой) полосатости были описаны Кули [75]. Вирусная природа болезни была установлена успешными опытами по передаче прививкой и повиликой Хорном [134] и Хорном и Вудсом [135].
Экономическое значение. Как считалось в течение ряда лет, (слабая) полосатость черной малины рассматривалась как причина серьезных потерь урожая черной малины [75, 135, 144, 263, 271]. Она еще встречается в плодовом поясе озера Эри [210]. Хотя в настоящее время болезнь не имеет большого значения в производстве ягод черной малины в США, все же она может ухудшить качество ягод, и ее следует рассматривать в качестве потенциальной угрозы.
Круг растений-хозяев. Черная малина (Rubus occidentalis L.) служит единственным хозяином в роде Rubus, на котором присутствие полосатости черной малины было доказано путем экспериментальной передачи вируса. Дикие формы R. occidentalis, а также дикие и культивируемые виды ежевики могут быть хозяевами, но доказательство основано только на визуальных симптомах [75, 242, 253, 263]. Повилика (Cuscuta subinclusa Dm. et Hilg.) была экспериментальным хозяином в том смысле, что она успешно использовалась для передачи полосатости [135]. Браун и Кеплингер [24] сообщили, что культивируемая земляника и Fragaria vesca L. заражались экспериментально.
Симптомы. Характерная полосатость на побегах представлена светло-голубыми или серыми полосами на молодых побегах, а иногда на плодоносящих побегах во время плодоношения. Зараженные растения не всегда проявляют полосатость, особенно если они не отличаются сильным ростом. На растениях симптомы заболевания могут не проявиться до следующего года [143]. Полосы обычно многочисленные в виде узких, водянистых линий длиной менее 255 см [75]. Симптомы полосатости развиваются во время теплых периодов, но не в холодную погоду [209]. Браун [22] согласен, что на развитие полосатости на побегах влияют окружающие условия. Зараженные растения обычно мощные и хорошо размножаются.

Рис. 89. Верхушка побега черной малины, на которой видно искривление листочков, вызванное инфекцией полосатости

Рис. 90. Слева - веточка со здоровыми ягодами; справа - инфекционные ягоды, образующиеся в результате поражения полосатостыо черной малины. Обратите внимание на большую величину и блеск здоровых ягод.)
Симптомы на листьях характеризуются крутым изгибом и скручиванием (рис. 89). Листья на больных растениях часто темнее, чем нормально зеленые [75]. Иногда на нижних листьях инфицированных побегов обнаруживается посветление жилок или крапчатость [144]. За исключением тепличных растений [135] симптомы на листьях более постоянны, чем полосы на побегах.
Мелкие костянки могут созревать неодновременно на плодовых веточках больных растений, придавая ягодам пятнистый вид. При уборке такие ягоды мелкие, семенистые, безвкусные, без глянца, в общем не имеют товарного вида (рис. 90). Цундель [272, 273] считал, что сухие, бурые ягоды являются результатом заболевания (слабой) полосатостыо. Однако Демари [87] считал, что поражения встречались независимо.
Характеристика вируса. (Слабая) полосатость передается экспериментально прививкой сближением и через повилику [135]. Поскольку полосатость черной малины передается прививкой, а грибы и бактерии не имеют постоянной связи с зараженными растениями, предполагают, что болезнь имеет вирусную природу.
Передача. а) Насекомые. На основе полевых наблюдений тли и цикадки рассматриваются в литературе как возможные переносчики полосатости черной малины. Несколько из них испытывали, но не было доказано, что они являются переносчиками. Были испытаны тли Aphis rubicola Oestlund [И, 196, 209] и Amphoro-phora sensoriata Mason [11, 135], цикадка Deltocephalus flavicosta Stal и цикадка пенница Philaenus leucophthalmus L. [135].
б) Передача прививкой. Хорн и Вудс [135] успешно передавали полосатость (слабую) черной малины прививкой сближением с зараженных на здоровые растения черной малины в 43 случаях из 55. Конверс (не опубликовано) не смог передать полосатость прививкой листом, хотя бутылочный способ прививки был сравнительно успешным. Браун и Кешшнгер [24] сообщили; что полосатость (слабая) черной малины передавалась прививкой срезанным листом на Fragaria vesca L. и на промышленные сорта земляники. Конверс (не опубликовано) не смог передать вирус прививкой листом на землянику сорта Альпине.
в) Передача через повилику. Хорн и Вудс [135] использовали повилику (Cuscuta subinclusa) для передачи (слабой) полосатости черной малины с черной малины на черную малину с положительным результатом в 8 случаях из 30.
г) Механическая передача. Хорн и Вудс [135] не смогли передать полосатость (слабую) механически соком с больных растений черной малины на здоровые.
д) Другие способы передачи. Уилкокс [253] не нашел доказательств о сохранении полосатости (резкой) в почве, но Конверс (не опубликовано) получил предварительные данные о том, что полосатость (слабая) развивалась на сеянцах малины, растущих на необработанной почве. Отсутствие успешных передач через прививку с таких сеянцев и появление полос на побегах сеянцев малины, которые не заражались, делают интерпретацию опытов по сохранению вируса в почве трудной. Необходим надежный биологический анализ этой инфекции.
Распространение в естественных условиях. Хотя естественные способы распространения полосатости не известны, имеется определенное доказательство того, что вирус распространяется в поле. Видимые заражения (слабой) полосатостью на данной плантации черной малины ежегодно удваиваются [75]. Растения, находившиеся в 3 м от зараженных растений, были в 3 раза более склонны к заражению, чем находившиеся на большем расстоянии [196]. Подобные данные сообщались Вудсом и Хаутом [263]. Джефферс и Вудс [144] провели наблюдения за проявлением полосатости (слабой) на плантации черной малины в Мэриленде, на которой в течение двух лет больные растения выкорчевывали, а затем выкорчевку не проводили в течение четырех лет. За этот период количество растений, пораженных полосатостью (слабой), возросло с 1,5 до 46,7%. Ранкин [196], Кули [75, 77], Джефферс и Вудс [145] и Торнтон [242] на основании своих наблюдений за распространением полосатости (слабой) заключили, что насекомые-переносчики играют важную роль в ее распространении.
Меры борьбы. Уничтожение дикой черной малины, избегание одичавших растений ее и дикой ежевики вблизи плантации черной малины - широко распространенный способ борьбы. Кули [77] отметил, что появление резких форм полосатости на плантации черной малины в Нью-Йорке при ежегодном удалении больных растений снизилось с 10% до менее чем 1% после уничтожения живой изгороди из ежевики, расположенной вблизи.
Удаление зараженных полосатостью растений из питомника является необходимым приемом. Обследование и выкорчевку больных растений следует проводить во время или после плодоношения черной малины в питомнике, т. е. до продажи посадочного материала [263]. Вудс и Хаут установили, что на новых листьях черенков таких сортов, как Камберленд и Данди, может обнаруживаться посветление жилок на растениях, зараженных слабой формой полосатости. Полагают, что близость к возделываемым плантациям ежевики увеличивает появление слабой формы полосатости [142]. При закладке новых плантаций желательна изоляция на расстоянии примерно 458 м от других видов сложноплодных, зараженных слабой полосатостью.
Терапия. Сведений нет.
Примечания. Зараженные сорта заметно различаются по типу и силе симптомов [196, 263]. Сообщалось, что сорта Блэк Бью-ти [263] и Импрувид Канзас [75] остаются свободными от полосатости (слабой), даже если высажены среди больных растений. Однако не изучалась устойчивость сортов к заражению через прививку. Селекция на устойчивость к полосатости, вероятно, не будет проводиться, если только не произойдет другая сильная вспышка и не будет доказана сортовая устойчивость.
Обнаружение и идентификация. Диагностика зависит от тщательности обследования подозреваемых растений в поле, так как не найдено лучших индикаторов, чем черная малина. Передача же полосатости прививкой на сеянцы малины является ненадежным методом, и развитие симптомов часто замедленно. Между тем на больных растениях могут быть обнаружены искривленные листья, посветление жилок, темно-зеленая листва и различной степени полосатость побегов. Наличие мелких, пятнистых, невкусных ягод, лишенных глянца, служит диагностическим признаком полосатости.
НЕКРОТИЧЕСКИЙ ШОК У РАСТЕНИЙ RUBUS (NECROTIC SHOCK IN RUBUS)
Синонимы. Нет. (Сокращенно NSV.)
История и географическое распространение. Заболевание известно только на севере Калифорнии с 1956 г. на Fragaria [96] и позднее на Rubus [95].
![Рис. 91. Симптомы некротического шока на ежевике сорта Гималайя, инокулированного в точке А прививкой. Виден некроз побега на первом междоузлии ниже места прививки. Заражение не было системным [95]](pic/000102.jpg)
Рис. 91. Симптомы некротического шока на ежевике сорта Гималайя, инокулированного в точке А прививкой. Виден некроз побега на первом междоузлии ниже места прививки. Заражение не было системным [95]
Экономическое значение. Заболевание не имеет явного экономического значения.
Круг растений-хозяев. Встречается на растениях Rub us и Fragaria. He известно об иммунности растений, но заражение на всех хозяевах Rubus не является симптомным.
Симптомы. В полевых условиях симптомы, связанные только с некротическим шоком, не удалось обнаруживать ни на Rubus, ни на Fragaria. Растения Rubus, экспериментально зараженные прививкой побегов, поражаются одним из двух взаимно исключающих способов: 1) заражение системное, но бессимптомное; 2) вирус вызывает некротизацию, но заражение не становится системным.
К растениям-хозяевам, на которых инфекция системная, но бессимптомная, относятся: сорт черной малины Мунгер, логанова ягода и Бойзен (Rubus loganobaccus), гибриды от скрещивания стелющейся ежевики (R. ursinus] с красной малиной. Логанова ягода и Бойзен - единственные растения-хозяева Rubus, которые были найдены естественно зараженными.
К растениям-хозяевам с некротической, несистемной реакцией относятся: ежевика Гималайя (R. procerus), сеянцы логановой ягоды, сорт стелющейся ежевики Олалли, малина японская (R. phoeni-colasius) и R. henryi. На этих хозяевах некроз появляется в месте прививки и распространяется вниз и вверх на одно или несколько междоузлий и окольцовывает побег, вызывая его отмирание (рис. 91). Распространение некроза вниз останавливается на первом или втором узле и ограничивается только инокулированным побегом. Однако некроз может охватывать всю надземную часть растения, вызывая гибель последнего. Такое поражение представляет лекальный тип реакции. В поле эти хозяева не могут рассматриваться в качестве вероятного источника вирусной инфекции.
Характеристика вируса. Сведений нет.
Передача. Вирус передавался только прививкой, но недавно он был перенесен с земляники на другие травянистые растения путем механической инокуляции (см. стр. 83). Переносчик не известен. После заражения прививкой симптомы развиваются примерно через три недели.
Распространение в естественных условиях. Способы распространения не выяснены.
Меры борьбы. Специальные меры борьбы не разрабатывались.
Терапия. Сведений нет.
Примечания. В США все выпускаемые сорта ежевики и малины проверялись на присутствие вируса некротического шока прививкой листом на Fragaria vesca L. var. semperflorens (Duchesne) Seringe (альпийская земляника) и были найдены свободными от этого вируса (Конверс, персональное сообщение о неопубликованном исследовании) [69].
Обнаружение и идентификация. Обнаружить вирус можно с помощью индикаторных растений F. vesca (альпийская земляника является наилучшим индикатором) и растений-хозяев Rubus, на которых развивается некроз побегов. Ежевика сорта Гималайя - превосходный индикатор, на котором локализованный некроз побегов является диагностическим признаком некротического шока.
СТЕРИЛЬНОСТЬ РАСТЕНИЙ RUBUS (STERILITY IN RUBUS)
Синонимы. (Сокращенно RStV.) Blackberry sterility.
История и географическое распространение. Такое "состояние" было описано Моррисом [178, 179]. В США до 1935 г. у ряда сортов ежевики в Техасе была обнаружена разная степень стерильности. То же было отмечено в Миссури в начале 1930-х годов. "Стерильность ежевики" в настоящее время является проблемой в большинстве штатов, в которых выращивают сорта прямостоячей и восточной стелющейся ежевики. Трудно получить формы более старых сортов, свободные от этого состояния. Оно обычно на диких растениях всюду в штате Миссури, где на многих приусадебных плантациях черной малины также обнаружены подобные симптомы.
Экономическое значение. Промышленные и приусадебные плантации черной малины при заражении вирусом стерильности становились бесплодными.
Круг растений-хозяев. Прямостоячая ежевика, восточная стелющаяся ежевика и черная малина.
Симптомы. По внешнему виду цветки нормальные; однако они или совсем не завязывают ягод, или образуют лишь несколько костянок (рис. 92, вверху). На листьях может развиваться мозаичный рисунок (рис. 92, внизу), хотя это может быть также объяснено присутствием в растениях других вирусов. Может наблюдаться покраснение побегов. Стерильность со временем может прогрессировать, но степень стерильности может варьировать год от года.
Возбудитель. Опыты по передаче прививкой, проведенные Хемп-филлом [126], указывают, что возбудителем является вирус.

Рис. 92. Вверху - ягоды ежевики сорта Альфред в результате стерильности цветков; внизу - листья с растения ежевики сорта Эрли Харвест, которому стерильность цветков была передана прививкой в корень
Передача. Вирус передавался на ежевике прививкой побегов или корней.
Распространение в естественных условиях. Сведений о переносчике нет. Распространение по плантации является сравнительно медленным. Плантации в штате Миссури становились бесплодными в течение, 5 - 10 лет после появления первых симптомов заболевания.
Меры борьбы. Сведений нет.
Терапия. Эффективная термотерапия не известна. Опыты по обработке корневых черенков горячей водой (50° С) и продолжительная обработка при повышенной температуре (42°С) на протяжении всего периода покоя не давали положительных результатов. Обнаружение и идентификация. Признаки болезни очевидны. Однако не во всех случаях частичная или полная стерильность у растений Rubus вызывается вирусом [69], и положительная идентификация зависит от успешной передачи прививкой.
ВИРУСЫ И ВИРУСНЫЕ БОЛЕЗНИ РАСТЕНИЙ ИЗ РОДА RUBUS, ИМЕЮЩИЕ МЕНЬШЕЕ ЗНАЧЕНИЕ
В настоящей статье разбираются семь вирусных болезней, обнаруженных на растениях из рода Rubus. Все они имеют или менее важное значение, или ограниченное распространение, или же описаны недостаточно подробно и поэтому не могут быть детально разобраны в настоящем справочнике.
Здесь рассматриваются следующие вирусы и вирусные-болезни: 1) вирус некроза табака-, 2) вирус полосатой курчавости табака; 3) крапчатость Бразо; 4) карликовость курчавая; 5) вырождение логановой ягоды; 6) "папоротниковидность листьев"; 7) мозаика гималайской малины.
1. Вирус некроза табака (TNV) - хорошо известный вирус, который передается через гриб Olpidium и подробно изучен на других растениях-хозяевах. Имеются сообщения, что он встречается в корнях растений рода Rubus, но экономическое значение его не известно [45].
2. Вирус полосатой курчавости табака (TRV) также хорошо изучен; это передающийся через нематод вирус, имеющий широкий круг хозяев, к числу которых относятся и представители рода Rubus. Экономическое значение для рода Rubus не известно [45].
3. Крапчатость Бразо - вирусная болезнь, вызывающая крапчатость на ежевике, в том числе на сорте Бразо; описана из Техаса де ла Гарца [103]. Вирус передается прививкой представителям рода Rubus и некоторым другим хозяевам, в том числе гибридной сливе Широ. С соком этой сливы вирус был передан коровьему гороху, табаку и тыкве. Идентичность его не установлена.
4. Курчавая карликовость. Прентис и Харрис [191] сначала описали курчавую карликовость обыкновенной малины из Англии только на основании опытов по передаче болезни путем прививки и проявления ее симптомов на определенных сортах красной малины. Первоначальное предположение, что курчавую карликовость передают тли [51], позднее было опровергнуто [45]. Растения красной малины, зараженные курчавой карликовостью, часто встречаются в Шотландии [32], но вопрос о зависимости между вирусом и переносчиком и о его взаимосвязях с вирусами мозаики, жилково-го некроза и другими нуждается в дополнительном изучении.
5. Вырождение логановой ягоды описано Леггом [16] только в Англии. Хотя на зараженных растениях логановой ягоды ясно выраженные симптомы болезни отсутствовали, но вес их плодов и побегов достигал всего лишь двух третей их веса у растений, не зараженных этим вирусом. Вирус обнаруживают путем прививки на Rubus henryi, у которого шоковые симптомы - хлороз и кольцевые узоры - сопровождаются появлением хронических симптомов хлороза и укорачиванием междоузлий. В Англии размножен клон логановой ягоды LY 59, свободный от этого вируса. Сведения о скорости распространения болезни в полевых условиях и о ее переносчиках отсутствуют. Поскольку в растениях логановой ягоды вирус вырождения находится в латентном состоянии, считается, что он не имеет отношения к карликовости ежевики (карликовость логановой ягоды). Кроме того, он, вероятно, не родствен и вирусу калико логановой ягоды, который не вызывает симптомов на R. henryi (Конверс, неопубликованные данные), тогда как симптомы, появляющиеся на растениях R. henryi, инокулированных .прививкой, являются диагностическими для вырождения логановой ягоды.
6. "Папоротниковидность листьев". Чемберлен [60] описал "папоротниковидность листьев" для одного клона сорта Кутберт малины красной в провинции Онтарио. Болезнь передавалась прививкой, но не передавалась через тлей и вызывала кольцевую и некротическую пятнистость, задержку появления листьев, остановку роста и образование розеток мелких, сильнозубчатых листьев, напоминающих листья папоротника. Цундель [270] описал сходные симптомы "папоротниковидности", обнаруженные на растениях черной малины в Пенсильвании. На основании сравнения симптомов Цундель высказал предположение, что эти растения были заражены вирусом мозаики огурца. Сообщения о дальнейшем изучении данной болезни отсутствуют. Весьма вероятно, что кольцевая пятнистость (но не симптом "папоротниковидности листьев") вызывалась вирусом кольцевой пятнистости томата, распространенным в провинции Онтарио (У. Аллен, неопубликованные данные).
7. Мозаика гималайской малины. Симптомы мозаики, кольцевой пятнистости, карликовости, хлороза и линейные узоры нередко встречаются на гималайской малине (Rubus ellipticus Smith) в северной холмистой области Индии [7]. Передача их от одних видов Rubus другим осуществлялась с помощью бутылочного метода прививки и через повилику (Cuscuta reflexa Roxb.). Компонент вируса линейного узора был выделен прививкой из этого комплекса, но связи описанного комплекса с изученными в Европе или в Северной Америке вирусами, поражающими виды Rubus, не известны.
ВИРУСОПОДОБНЫЕ ЗАБОЛЕВАНИЯ НА РАСТЕНИЯХ RUBUS
Известны заболевания, при которых возникают вирусоподобные симптомы, но причина которых не известна или обусловлена окружающими условиями и приемами агротехники. Эти заболевания включают: фасциацию, рассыпчатость ягод, аномалии, вызываемые воздействием температуры, несбалансированностью минеральных элементов и пестицидной фитотоксичностью.
1. Фасциация. Фултон [102] сообщил о редком появлении фасциированных побегов на черной малине в штатах Мичиган и Мэриленд (рис. 93). Растения, несущие такие побеги, на следующий год развивают нормальные побеги.
2. Рассыпчатость ягод. Везде, где выращивается малина, часто встречаются случаи, где костянки созревают неодновременно или плохо скреплены. Недавно было установлено, что рассыпчатость ягод у сорта красной малины Хилтон в восточных штатах США (Конверс и Эндо, не опубликовано) была связана с вирусом кольцевой пятнистости томата. Однако представляется вероятным, что многие другие факторы также могут влиять на развитие костянок. Как показано в литературе [69, 86], причинами рассыпчатости могут быть: генетические особенности, окружающие условия, повреждения, вызываемые насекомыми, и вирусные инфекции.
3. Аномалии, вызванные температурой. Холодная погода и весенние заморозки увеличивают появление на листьях малины вирусоподобных симптомов. Некоторые из них были экспериментально воспроизведены и хорошо проиллюстрированы Беннеттом [11], Один особенно отчетливый симптом ярко-желтого посветления жилок часто встречается в конце весны на полностью распустившихся листьях черной малины в среднеатлантическом районе США. Растения могут образовывать такие листья в течение двух лет подряд, но попытки передать это заболевание были безрезультатными (Конверс, не опубликовано). В штате Вашингтон подобным симптомам на листьях красной малины дано название "калико".
4. Несбалансированность минеральных элементов. При избытке и недостатке минеральных элементов на растениях Rubus часто образуются характерные симптомы. По этому вопросу имеется обзоо Льонса [168]. В местностях, где обычны известковые почвы и реакция почвы щелочная" малина часто страдает от недостатка железа. Пораженные растения становятся хлоротичными, а в тяжелых случаях на листьях развиваются некротические участки. Между сортами имеются заметные различия по устойчивости к хлорозу, вызываемому избытком извести. Для устранения этой недостаточности проводят опрыскивания листьев циклическими соединениями (хелатами) железа.
5. Пестицидная фитотоксичность. Некоторые пестициды, особенно динокап*, вызывают желтую и зеленую пятнистость на листьях малины, когда опрыскивания проводят в жаркую погоду.
*(В СССР не применяется. - Ред.)
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://wine.historic.ru/ 'Виноделие как искусство'