
Часть 4. ВИРУСНЫЕ И ВИРУСОПОДОБНЫЕ БОЛЕЗНИ ВИНОГРАДА
ВВЕДЕНИЕ
ВИРУСНЫЕ И ВИРУСОПОДОБНЫЕ БОЛЕЗНИ ВИНОГРАДА
Самые ранние исследования, посвященные вирусным болезням винограда, несколько отстали от изучения вирусных болезней ряда других плодовых культур. Но за последние годы в этой области отмечается быстрый прогресс. Международный совет по изучению вирусов и вирусных болезней винограда, в организации которого некоторые из нас принимали участие в 1962 г., и первое собрание его, происходившее в Нионе, Швейцария, в 1964 г., благоприятствовали обмену методами и результатами исследований и, таким образом, в большей мере способствовали развитию интереса к изучению вирусов и вирусных болезней винограда.
До 1960 г. было обнаружено лишь небольшое число вирусных болезней виноградной лозы: болезнь Пирса, золотистое пожелтение, скручивание листьев, короткоузлие, желтая мозаика, окаймление жилок и некроз.
Исследование вирусов, передающихся через почву, быстро расширилось после того, как было показано, что вирус короткоузлия переносили нематоды и что его можно механически передавать травянистым растениям-хозяевам.
К моменту написания настоящего справочника было описано 19 вирусных болезней винограда. Семнадцать различных вирусов вызывали болезни винограда и входили в состав разных болезнетворных комплексов. Инфекционное вырождение (короткоузлие) вызывается, по-видимому, комплексом вирусов, включающим вирусы короткоузлия винограда, мозаики резухи, черной кольцевой пятнистости томата, кустистой карликовости томата и, возможно, мозаики табака. Имеются, несомненно, и другие вирусы. Степень их комплексности варьирует в зависимости от виноградника и состава культивируемых в нем сортов. Из отдельной лозы удавалось выделить один - три, а возможно, и четыре вируса. Сложную природу вирусов, связанных с болезнями винограда, показали Стельмах и Беркс в ФРГ, Мартелли в Италии и Вюйтене во Франции (см. многочисленные ссылки в списке литературы). Комплексы, обнаруженные до настоящего времени в Калифорнии, включали, помимо вируса скручивания листьев винограда, вирусы короткоузлия, пожелтения жилок, пятнистости и опробковения коры винограда.
Вирус скручивания листьев винограда часто встречается в сочетании со многими другими вирусами и известен во многих районах земного шара.
Сами вирусы изучены слабо; только некоторые из передающихся через почву были выделены ,и очищены, и была установлена их взаимосвязь с другими вирусами.
В природе вирусные болезни винограда распространяются при посредстве цикадок и нематод. Тли или ряд других переносчиков, участвующих обычно в передаче некоторых вирусов других ягодных культур, как переносчики вирусов винограда не известны.
Передающиеся через почву вирусы, поражающие виноградную лозу, составляют любопытную группу, включающую вирусы мозаики резухи, короткоузлия винограда, черной кольцевой пятнистости томата, кустистой карликовости томата, пожелтения жилок винограда и розеточной мозаики персика. Переносчиком всех вирусов, за исключением последнего, являются нематоды из очень близких родов Xiphinema и Longidorus. Вирус розеточной мозаики персика, по-видимому, также переносит нематода. Этим вирусам свойственны и многие другие общие черты. Так, все их можно передать механически широкому кругу растений-хозяев из числа травянистых и некоторых древесных растений как однолетних, так и многолетних.
В целом эти вирусы являются хорошими антигенами, обладают очень сходными физическими свойствами, сходны морфологически, и многие из них передаются с семенами, по крайней мере некоторых травянистых растений-хозяев.
При обследовании виноградников в Турции в районе Эгейского моря и ознакомлении с соответствующими вирусными болезнями винограда во многих странах я пришел к выводу, что они, вероятно, очень близки между собой и, возможно, имеют даже общее происхождение; родиной их могли быть районы древней Персии. Отсюда вирусы могли легко рассеяться с различным посадочным материалом.
В начале развития торговых связей, освоения новых районов и переселений вирусы вместе со своими переносчиками акклиматизировались в других странах. После нескольких сотен лет существования в новых странах вирусы могли измениться, превратившись в варианты исходного вида. Формы, известные нам в настоящее время, вероятно, представляют собой вирусы, различающиеся по крайней мере серологически и поражающие разные растения-хозяева. Нематоды, расселившиеся вместе с этими вирусами, в свою очередь, могли измениться и поэтому в настоящее время классифицируются, очевидно, иначе. Необходимо собрать различные штаммы этих вирусов, провести тщательное сравнительное изучение возможных взаимосвязей и определить, воз-можны ли скрещивания между вирусами. Исследования подобного типа помогут составить лучшие представления о вероятных взаимоотношениях.
Можно почти не сомневаться, что вирус короткоузлия винограда появился из древней Персии. Об этом говорят следующие доказательства. Во-первых, я находил этот вирус в изолированных виноградниках, состоявших из корнесобственных лоз, считавшихся потомками лоз, переходивших из поколения в поколение в районе Турции, прилегающем к Эгейскому морю. Вюйтене, наблюдавший этот вирус в некоторых тех же виноградниках, что и я, совершенно независимо пришел к такому же заключению. Во-вторых, только сорта Vitis vinifera L. проявляют толерантность или даже устойчивость к вирусу короткоузлия винограда. Виды Vitis из других районов мира, которые подвергались испытанию, резко реагировали на присутствие штаммов вируса короткоузлия.
Нами отмечено также, что некоторые сорта V. vinifera, привитые на американские гибридные подвои, также сильно реагировали на заражение вирусом.
Родиной вируса болезни Пирса являются, по-видимому, равнины на побережье Мексиканского залива в Северной Америке. Многие виды Vitis, произрастающие в этой области, толерантны или устойчивы к данной болезни.
Происхождение других вирусов, поражающих виноградную лозу, проблематично. Имеющиеся данные недостаточны для обоснования правильного предположения.
БОЛЕЗНЬ ПИРСА ВИДОВ VITIS (PIERCE'S DISEASE OF VITIS SPECIES)
Синонимы. Anaheim disease; California vine disease [164, 227].
История и географическое распространение. Болезнь Пирса распространена в Калифорнии и в штатах, прилегающих к Мексиканскому заливу. Впервые болезнь была идентифицирована примерно в 1884 г. в южной части Калифорнии вблизи Помоны и Анахайма [227] в северной части Калифорнии в округе Нала в 1887 г. [159, 2271 в Ливерморе в 1888 г. [159, 227] и в долинах Сакраменто и Сайта Клара - около 1900 г. Первое сообщение о появлении болезни в долине Сан-Хуакин появилось, по-видимому, около 1921 г. [159 162]. В период эпифитотии 1935 - 1940 гг. она была обнаружена в основных районах виноградарства Калифорнии [159]. Вторая вспышка заболевания произошла в долине Напа в 1960 - 1962 гг.
В Техасе болезнь Пирса была впервые отмечена в области Каррисо-Спрингс в 1941 г. [159], а в 1953 г. она была признана одной из главных причин вырождения винограда во Флориде [270]. В штате Миссисипи вирус был идентифицир. в 1956 г. [159, 168].
Тот факт, что к болезни Пирса устойчивы только те виды Vitis, которые являются уроженцами штатов, прилегающих к Мексиканскому заливу (Флорида, Джорджия, Миссисипи, Алабама, Луизиана и Техас), показывает, что вирус также происходит из этих мест или существовал здесь в течение длительного периода [89, 159, 168]. Хотя об этой болезни сообщалось также из Чили и Аргентины, автор не смог при обследовании в 1964 - 1965 гг. обнаружить это заболевание в виноградниках Чили или около Мендосы (Аргентина).
Экономическое значение. Болезнь Пирса способна уничтожить огромное число лоз и сделать район непригодным для выращивания обычных сортов винограда. Она убивает сорта Vitis labrusca L, и V. vinifera L., которые составляют большую часть промышленных виноградников во всем мире.
В Калифорнии болезнь Пирса уничтожила за четыре эпифитотии около 30000 га виноградников. Главными центрами эпифитотии в 1884 - 1900 гг. являлась Южная Калифорния, в 1914 - 1918 гг.- долина Сайта Клара, в 1935 - 1940 гг. - долины Сан-Хуакин и Нэпа и в 1960 - 1962 гг. - долина Папа.
Посадки в области Каррисо-Спрингс (Техас) болезнь уничтожила в 1941 - 1943гг.
В некоторых районах болезнь эндемична, в связи с чем культура винограда там практически невозможна. Начиная со вспышки в бассейне Лос-Анджелеса в 1900 г. болезнь Пирса стала эндемической на местных растениях. Почти все посадки винограда, производившиеся с тех пор в этом бассейне, через 5-7 лет погибали от болезни.
К настоящему времени достаточно убедительно доказано, что болезнь Пирса является главным фактором, ограничивающим культуру винограда в штатах, прилегающих к Мексиканскому заливу, и во многих других южных штатах [159].
Круг растений-хозяев. Вирус был выделен из представителей примерно 28 семейств однодольных и двудольных растений, в том числе из злаков, трав, кустарников, деревьев, как из однолетних, так и многолетних растений [121, 164, 165]. Круг растений-хозяев определяли тремя способами по видам растений: естественно зараженных, искусственно зараженных при помощи насекомых-переносчиков и инокулированных прививкой.
Вирус был выделен из растений при посредстве насекомых-переносчиков и передан последними на растения индикаторных сортов винограда.
Список видов растений, известных в качестве хозяев вируса, приводится ниже без авторов видовых названий.
Gramineae (злаки): овсюг (Avena fatua), костер слабительный (Bromus catharticus), костер прямой (Bromus rigldus), Bromus sp., свинорой пальчатый (Cynodon dactylon), росичка кровяная (Digitaria sanguinalis), просо куриное (Echinochloa crusgalli), полевичка (Eragrostis diffusa), овсяница (Festuca megalura), гумай (Sorghum halepense), суданская трава (S. vulgare sudanense), ячмень заячий (Hordeum murinum), ячмень (Я. vulgare), райграс многоукосный (Lolium multiflorum), плевел опьяняющий (L. tem.ulentu.rn), паспалум расширенный (Paspalum dilatatum), пеннисетум (Pennisetum clandestinum), канареечник малый (Phalaris minor), P. paradoxa, тимофеевка луговая (Phleum pratense), мятлик однолетний (Роа аппиа), щетинник сизый (Setaria glauca).
Cyperaceae (осоковые): сыть съедобная, чуфа (Cyperus esculentus).
Cannaceae (канновые): канна (Саппа spp.).
Salicaceae (ивовые): ива (Salix spp.).
Urticaceae (крапивные): крапива (Urtica gracilis var. holosericea).
Polygonaceae (гречишные): горец вьющийся (Polygonum convolvulus), блош-ная трава (Р. persicarla), ревень (Rheum rhaponticum), щавель курчавый (Rumex crispus).
Chenopodiaceae (маревые): марь душистая (Сhenopodium ambrosioides).
Saxifragaceae (камнеломковые): Escallonia montevidensis, гортензия (Hydrangea macrophylla), чубушник (Philaddphus coronarius).
Resedaceae (резедовые): резеда душистая (Reseda odorata).
Pittosporaceae: Pittosporum crassifolium.
Rosaceae (розоцветные): ежевика калифорнийская (Rubus vitiofolius), шиповник калифорнийский (Rosa calif arnica), кизильник (Cotoneaster rotundifolia lanata), Heteromeles arbutifolia.
Leguminosae (бобовые): акация (Acacia longifolia), ракитник метлистый iCytisus scoparius), нут (Cicer arietinum), чина (Lathyrus clymenum), люцерна (Medicago hispida), донник белый (Melilotus alba), донник белый однолетний {M. alba аппиа), донник индийский (М. indica), донник желтый (М. officinalis), донник (Melilotus sp.), клевер земляничный (Trifolium fragiferum), клевер белый (Т. repens), клевер ладино (Т. repens f. giganteum), клевер гибридный (Т. hybridum), клевер инкарнатный (Т. incarnatum), клевер красный (Т. pratense), вика (Vicia articulata), вика посевная (V. sativa).
Geraniaceae (гераниевые): аистник цикутовый (Erodium cicutarium), герань (Pelargonium hortorum).
Anacardiaceae (сумаховые): сумах (Rhus diversiloba).
Vitaceae (виноградовые): виноград культурный (Vitis vinifera), V. labrusca, V. californica, V. arizonica, V. rotundifolia, дикий виноград (Parthenocissus tricuspidata).
Myrtaceae (миртовые): Eugenia myrtifolia.
Onagraceae (кипрейные): кипрей (Epilobium californicum), E. paniculatum, кларкия стройная (Clarkia (Godetia) concinna), ослинник (Oenothera hookeri), фуксия (Fuchsia magellanica).
Araliaceae (аралиевые): плющ обыкновенный (Hedera helix).
Umbelliferae (зонтичные): морковь культурная (Daucus carota var. sativa), омежник (Oenanthe sarmentosa).
Oleaceae (маслиновые): ясень (Fraxinus dipetala), сирень (Syringa vulgaris).
Apocynaceae (кутровые): барвинок большой (Vinca major).
Boraginaceae (бурачниковые): Amsinckia douglasiana.
Verbenaceae (вербеновые): Duranta repens (plumieri).
Labiatae (губоцветные): мята лимонная (Melissa officinalis), мята (Mentha spp.), душица (Origanum majorana), розмарин лекарственный (Rosmarinus officinalis).
Scrophulariaceae (норичниковые): вероника (Veronica spp.).
Rubiaceae (мареновые): Coprosma baueri.
Caprifiliaceae (жимолостные): жимолость японская (Lonicera japonica), бузина голубая (Sambucus caerulea), снежноягодник (Symphoricarpos albus).
Compositae (сложноцветные): полынь обыкновенная (Artemisia vulgaris var. heterophylla), бакхарис (Baccharis pilularis), астра однолетняя (Callistephus chinensis), Fransena acanthicarpa, латук компасный (Lactuca serriola), осот (Sonchus as per), дурнишник (Xanthium strumarium var. canadense).
Устойчивые виды. Устойчивостью к болезни Пирса обладают исключительно местные виды винограда с побережья Мексиканского залива [159], в том числе Vitis bourquiniana Munson, V. champinii Planchon, V. coriacea Shuttleworth, V. rupestris Scheele, V. rotundifolia Michaux и V. simpsonii Munson. К этой болезни устойчивы сорта Ленуар, Хиббермонт и Иона.
Симптомы. Кусты, пораженные болезнью Пирса, могут погибнуть через несколько месяцев или сохраняться в живых до 5 лет [164]. Быстро растущие молодые лозы редко выживают больше одного сезона после появления симптомов, в то время как более старые кусты часто живут дольше. В областях с прохладным климатом больные лозы обычно живут дольше, чем в жарком климате. Некоторые сорта, например Бессемянный Томпсона, Рибье и Птит Сира, обычно выживают дольше, чем сорта Мисьон, Кариньян, Имперор и Кардинал..
Внешние симптомы. Первыми признаками заражения болезнью Пирса служат ожог и побурение частей листьев (рис. 94, вверху). Эти первичные симптомы могут появиться в любое время второй половины вегетационного периода. Ожог листьев характеризуется внезапным высыханием части листа, в остальном остающегося зеленым; высыхает обычно участок, простирающийся от края листа вокруг главной жилки. Высохшие участки постепенно буреют и тогда уже называются ожогами ("burns"). Ткань, прилегающая к обожженным (т. е. побуревшим) участкам, желтеет или краснеет в зависимости от окраски плодов данного сорта. Побуревшие (обожженные) участки могут появиться в нескольких точках одного листа и на нескольких листьях побега; ожог может занимать различную площадь - от небольшого участка до половины всей поверхности листа. Ожог и побурение часто распространяются зонами от края листа до черешка. Симптомы появляются обычно на одном побеге, но с течением времени развиваются и на дополнительных побегах.
В конце сезона листья с симптомами болезни Пирса часто опадают, тогда как черешки остаются на побегах.
На побегах, имеющих симптомы болезни на листьях, рост плодов может прекратиться на любой стадии развития, после чего ягоды увядают и высыхают (рис. 94, внизу). Если симптомы впервые проявляются на побегах в конце сезона, плоды могут преждевременно окраситься до увядания.
Кора на пораженных побегах часто вызревает неправильными пятнами, участки бурой коры перемежаются с участками незрелой зеленой коры.
Зеленая ткань побегов обычно отмирает при низких зимних температурах.
На второй год и в последующие сезоны появляются вторичные симптомы - задержка роста весной, карликовость пораженных частей лозы и зеленоватое окаймление жилок на первых восьми листьях побега на пораженной части куста [142]. Листья могут быть несколько деформированными в результате сморщивания ткани вдоль жилок. Зеленое окаймление жилок обычно сильнее выражено на нескольких первых базальных листьях побега (рис. 95) и менее сильно на листьях, образовавшихся позднее. В середине лета на листьях больных лоз появляются первичные симптомы.

Рис. 94. Вверху - последовательные стадии развития краевого ожога листьев, первичного симптома болезни Пирса, на сорте Паломино (Vitis vmtfera). Внизу - плоды с куста сорта Паломино, пораженного болезнью Пирса. На левой кисти ягоды нормальные, тогда как на остальных заметно отставание ягод в развитии и конечное сморщивание их
На ранних стадиях болезни корни лоз кажутся нормальными, но по мере ее развития они отмирают. Отмирание корневой системы происходит обычно вслед за отмиранием надземной части лозы [142]. Часто последней отмирает корневая шейка у поверхности почвы.
Внутренние симптомы. Древесина прироста текущего года побегов, рукавов, штамба и корней пораженных лоз характеризуется наличием штрихов от желтой до бурой ткани, которые легко обнаружить на продольных или поперечных срезах. Бурые участки нормально вызревшей древесины на побегах больных лоз имеют хорошо выраженный слой коры, тогда как на зеленых участках этих побегов кора отсутствует. В ксилемной паренхиме, подстилающей бурые участки побега, содержится крахмал; в тканях, подстилающих зеленые участки, крахмал не обнаружен [106].
Вирус болезни Пирса содержится, по-видимому, исключительно в ксилеме [106, 142], будучи одним из двух вирусов с таким строго ограниченным местопребыванием в растении (вторым является вирус болезни "фони" персика). Вирус болезни Пирса передается прививкой вприклад или окулировкой глазком со щитком, содержащим ткани ксилемы и флоэмы, а не только флоэмы и коры [176]. Переносчики отличаются способностью питаться в ксилеме и во время питания выделять большие количества воды. В огромном большинстве случаев следы питания переносчика кончаются в ксилеме [106].
Первым результатом воздействия вируса на растения является образование камеди в сосудах древесины прироста текущего года [106, 176]. У молодых лоз при инокуляции цикадками одного листа первым признаком болезни явилась закупорка сосудов на расстоянии нескольких микронов от конечной точки укола, произведенного насекомым в процессе питания [106, 176]. Отложение камеди происходит до проявления внешних симптомов, и ее можно обнаружить во всех типах клеток древесины молодых и старых лоз, пораженных болезнью. Камедь, первый внутренний симптом заражения, была обнаружена в тканях через 24 ч после инокуляции цикадками, в то время как первые внешние симптомы заболевания появились через 55 дней после питания цикадок на лозе [176].

Рис. 95. Побег сорта Малага (Vitis vinifera); видно зеленое окаймление жилок, связанное с болезнью Пирса. В первом году заболевания эти симптомы не развиваются; окаймление жилок появляется только во второй и последующие сезоны. Окаймление жилок разовьется только на первых восьми листьях побега
Тиллы обнаружены в громадных количествах в сосудах любых размеров в древесине больных лоз. Они не всегда связаны с камедью. В здоровых лозах число тиллов в сосудах возрастало с возрастом древесины, тогда как в больной ткани число их было значительно выше, но при обратной зависимости частоты от возраста. В новой древесине тиллы и камедь закупоривали большое число сосудов [106].
Закупорка сосудов камедью и тиллами полностью объясняет появление сильного ожога и побурения листьев, характеризующих болезнь Пирса. Несомненно, закупорка в значительной мере служит причиной весенней гибели почек, задержки распускания листьев и общей карликовости кустов винограда.
Возбудитель. Природа вируса болезни Пирса не изучена.
Передача. Вирус передается прививкой и цикадками. Многочисленные виды этих насекомых, относящиеся к семействам Tettigelli-пае и Aphrophorinae, известны как переносчики вируса болезни Пирса [118, 119, 120, 164, 167, 207, 261, 262]. Вирус сохраняется в большинстве переносчиков, исследованных с этой точки зрения. Переносчик может воспринять вирус за 12 ч, а передавать его способен в некоторых случаях в течение всей своей жизни [261].
В качестве переносчиков указаны следующие виды: Сагпеосе-phala flaviceps (Riley), С. fulgida Nott., С. triguttata Nott., Cuerna costalis (Fab.), C. occidentalis Oman et Beamer, C. yuccae Oman et Beamer, Draeculacephala antica (Walker), D. crassicornis Van Duzee, D. minerva Ball., D. noveboracensis (Fitch.), D. portola Ball., Friscanus friscanus (Ball), Graphocephala cythura (Baker), Helochara delta Oman, Homalodisca insolita (Walker), H. liturata Ball, Hordnia circellata (Baker), Keonolla confluens (Uhler), K. dolobrata Ball, Neokol-la hieroglyphica (Say), N, severini De Long, Oncometopia orbona (Fab.), Pagaronia confusa Oman, P. furcata Oman, P. tredecimpunctata Ball и Р. tritunata Ball.
Распространение в естественных условиях. Вирус распространяется естественным путем в Калифорнии и в районах, прилегающих к Мексиканскому заливу. Основными переносчиками, передающими вирус винограду в Калифорнии, являются Carneocephala fulgida, Draeculacephala minerva и Hordnia circellata [142]. Имеются сообщения, что во Флориде вирус передают Carneocephala flaviceps, Draeculacephala portola, Homalodisca insolita, H. liturata и Oncometopia orbona [89, 207, 270].
Меры борьбы. Меры борьбы с болезнью Пирса винограда отсутствуют. Предпринимались многочисленные попытки подавить ее распространение, применяя опыливание инсектицидами для уничтожения переносчиков. Но все опыты заканчивались неудачей. Все попытки прекратить распространение болезни путем выбраковки кустов и изменения агротехники также не дали положительных результатов [344].
Устойчивость к этой болезни присуща нескольким видам Vitis и некоторым сортам, например сорту Иона. В связи с этим нужно было бы исследовать характер наследования устойчивости. Разработать программу борьбы с переносчиками можно будет после изучения их жизненных циклов и условий размножения, а также факторов, влияющих на развитие этих насекомых.
Примечания. Болезнь Пирса можно спутать с болезнью, известной под названием хлоротическое скручивание листьев, а также с проявлением недостаточности бора у многих сортов винограда. Симптомы хлоротического скручивания листьев очень близки к вторичным весенним симптомам болезни Пирса. Причина хлоротического скручивания листьев не выяснена. Но последняя наблюдалась в Аргентине и в Чили, т. е. в странах, из которых сообщалось также о болезни Пирса. Некоторые из внутренних симптомов, описанных для болезни Пирса, связаны также с борным голоданием винограда [37].
Обнаружение и идентификация. Присутствие вируса определяют путем передачи его индикаторным растениям прививкой или насекомыми-переносчиками. Точная природа вируса, как уже указывалось выше, не изучена.
Растения-индикаторы. Многие сорта Vitis vinifera и V. labrusca вполне пригодны в качестве индикаторов. Для этой цели используются обычно сорта V. vinifera - Кариньян, Имперор и Паломино.
ЗОЛОТИСТОЕ ПОЖЕЛТЕНИЕ (FLAVESCENCE DOREE)
Синонимы. Maladie du Baco 22 A; bois noir; flu; noirot.
История и географическое распространение. Симптомы золотистого пожелтения давно уже известны в определенных районах Европы: Бургундии, Юры и немецкой части долины р. Мозель. Однако болезнь не была идентифицирована. Как виноградари, так и ученые склонны были считать ее стадией скручивания листьев или принимали ее за краснуху или желтуху. И лишь во время внезапной и сильной вспышки, достигшей масштаба эпифитотии, проявились все специфические особенности болезни. Вспышка возникла в Гасконии, на юго-западе Франции, в 1949 - 1955 гг., нанесла большой ущерб виноградникам и привела к систематическому изучению болезни.
Золотистое пожелтение (ЗП) встречается в двух резко выраженных формах: локализованной и эпифитотической. В старых центрах заражения (Бургундия, Юра), болезнь остается локализованной, и распространения ее не наблюдается; симптомы появляются на зараженных лозах ежегодно, причем некоторые из них регулярно бывают выражены очень сильно, другие - слабо. На больных растениях симптомы могут отсутствовать в течение года или нескольких лет, но болезнь имеет тенденцию вновь появляться на одних и тех же растениях, а не на окружающих "здоровых" кустах. Относительная непрерывность патологического состояния, сохраняющаяся из года в год, ослабляет растение, которое в конце концов часто погибает (табл. 13). Некоторые зараженные виноградники могут вновь приобрести здоровый вид как в результате гибели больных растений, так и вследствие общего выздоровления всех зараженных лоз.

Таблица 13. Золотистое пожелтение в старом очаге инфекции. Развитие болезни в течение 5 лет на делянке сорта Шардонне в департаменте Юра
Примечание. Индексы (показатели) болезни обозначаются цифрами от 0 до 5 в соответствии с долей пораженных побегов на растении. Ноль означает отсутствие симптомов на растении, ранее страдавшем от болезни. Точка показывает, что за весь период наблюдений растение не поражалось болезнью. Плюс обозначает мертвое растение. Симптомы ежегодно появлялись вновь на одних и тех же растениях. Значительное отмирание на делянках возникало в результате повторных ежегодных поражений золотистым пожелтением одних и тех же растений.
Эпифитотическая форма золотистого пожелтения носит совершенно иной характер. Эпифитотия развилась в Гаскони с 1949 г., по-видимому, в результате встречи вируса золотистого пожелтения с цикадкой североамериканского вида Scaphoideus littoralis Ball., завезенной, как выяснилось недавно, в южную часть Франции. Как правило, у лоз сорта Бако 22А в условиях эпифитотии с самого начала болезни проявляются системные симптомы (так называемый кризис). После первого года симптомы на кустах ослабевают; они или локализуются на определенных побегах, или растения имеют совершенно здоровый вид. То или иное из этих двух состояний наступает ежегодно и носит явно случайный характер (табл. 14). Однако лозы, защищенные от вспышки путем пересадки или обработки инсектицидами, явно выздоравливают.
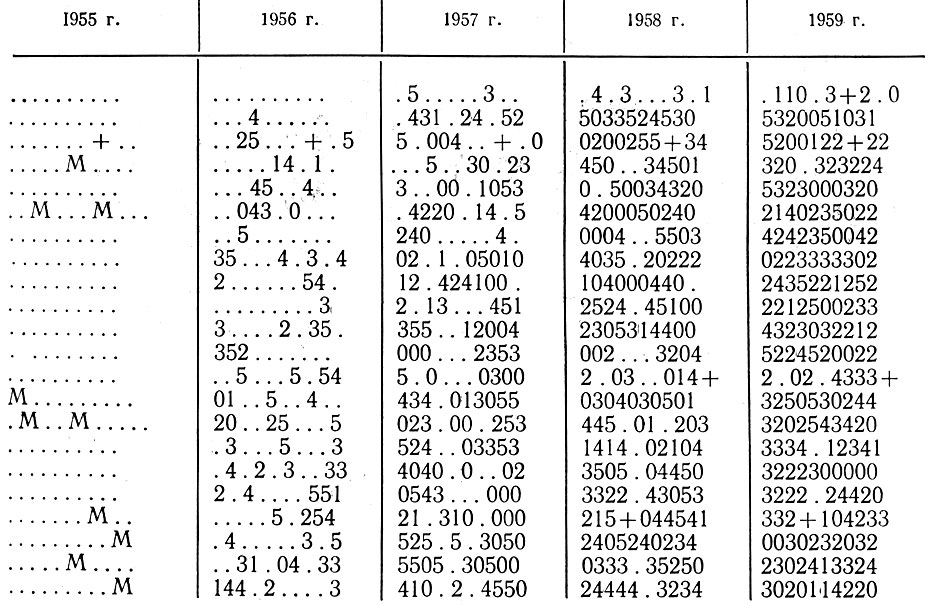
Таблица 14. Золотистое пожелтение на пораженной эпифитотией делянке сорта Бако 22А в Арманьяке
Примечание. Обозначения идентичны с принятыми в таблице 13, с той разницей, что в 1955 г. больные растения обозначались буквой М без учета степени поражения. Через 5 лет все растения на делянке оказались зараженными.
Золотистое пожелтение, обнаруженное первоначально в нескольких деревнях Нижнего Арманьяка и Шалосса на юго-западе Франции, из года в год регулярно распространялось, пока не заняло к настоящему времени всю область от Гаронны до Пиринеев. Идентичные симптомы были отмечены в Израиле и Швейцарии в районе озера Леман. В некоторых районах ФРГ болезнь приняла, по-видимому, характер эпифитотии, и в форме слабой эпифитотии была обнаружена также вблизи Безье, во французской зоне Средиземноморья.
Экономическое значение. Побеги, пораженные ЗП, не плодоносят; по окончании цветения соцветия обычно сразу высыхают. Иногда уже сформировавшиеся плоды съеживаются и приобретают исключительно горький вкус. Зараженные побеги не вызревают и в зимний период отмирают, так что плодовых почек под урожай будущего года может быть очень мало. Сила роста всего виноградника не восстанавливается в течение нескольких лет, а в дальнейшем ее восстановление возможно лишь при отсутствии рецидивов болезни. Там, где болезнь не достигает масштаба эпифитотии, больные лозы дают очень низкий урожай и часто отмирают. Подобное положение может привести к потере 20 - 30% урожая.

Рис. 96. Золотистое пожелтение. Слева - побег сорта Бако 22А с заторможенным ростом. Листья начинают налегать друг на друга, а растущие верхушки побегов некротизируются; справа - тот же сорт с признаками незрелости побега. Трещины на коре и черные пустулы могут располагаться продольными рядами
Там, где болезнь достигает масштаба эпифитотии и борьба с нею не ведется, зараженные кусты регулярно страдают от рецидивов и совершенно высыхают. Подобное положение привело к полному разорению многих виноградарей на юго-западе Франции. Если путем обработки инсектицидами предупредить повторную инокуляцию, лозы выздоравливают, рецидивы в дальнейшем не возникают и после нескольких катастрофичных лет виноградник снова становится продуктивным.
Круг растений-хозяев. Изучение поведения виноградных лоз, зараженных естественным путем и экспериментально при помощи цикадки Scaphoideus littoralis, показало, что ни один вид или сорт винограда не обладает полной устойчивостью к золотистому пожелтению. Во Франции наиболее восприимчивыми сортами (пригодными для использования в качестве индикаторов) являются: на юго-западе - Бако 22А и Жюрансон, в восточно-центральной зоне - Шардонне и на юго-востоке - Арамон. В ФРГ болезнь наблюдается на сорте Рислинг, но симптомы ее выражены сильнее на сорте Шой-Ребе 588 ( = СильванерХРислинг; сеянец 88). В Израиле к ЗП восприимчивы Перл оф Чаба и Мадлен Оберлен.
Неоднократно делались попытки передать вирус золотистого пожелтения травянистым растениям. Результаты, полученные в опытах с повиликой на Plantago lanceolata L. и Trifolium repens L., не подтвердились, и в настоящее время для опытов используется только виноград.
Симптомы. а) Клинические симптомы. Еще до появления любых других симптомов прекращается рост лозы. Это можно заметить на побегах или листьях; у последних некоторые части пластинок атрофируются. Характерные симптомы появляются только после периода соответственного солнечного освещения. У наиболее восприимчивых сортов, например Бако 22А, лоза часто принимает плакучую форму, побеги сгибаются, как каучуковые. Листья твердеют, закручиваются книзу и начинают налегать друг на друга, как чешуя, придавая побегу характерный вид, напоминающий змеиную кожу. Более детальное исследование обнаруживает частое отсутствие признаков зрелости по всей длине побега и, как сообщает Гертель [131], присутствие черных пустул, расположенных продольными рядами. Точки роста быстро некротизируются (рис. 96).
На твердых и хрупких листьях появляются золотисто-желтые участки, сосредоточенные на наиболее открытых действию солнечных лучей частях. Затем кремово-желтые пятна появляются и на жилках, нередко распространяясь по всей их длине. Иногда эти пятна в массе сосредоточиваются на определенных участках листа, точно ограниченных двумя или тремя жилками. Обычно эти кремово-желтые пятна быстро некротизируются и придают зараженной лозе характерный облик.
При раннем заражении все соцветие целиком высыхает и превращается в пыль. При более позднем - ягоды сморщиваются раньше, чем засыхают гребни и плодоножки. Плотная волокнистая мякоть имеет горький вкус, и ягоды непригодны к употреблению (рис. 97). У некоторых сортов, например Бако 22А, ягоды при малейшем толчке опадают.
б) Гистологические симптомы. Флоэма и сердцевина необычно сильно развиты по сравнению с древесиной, и волокна флоэмы образуются редко и неправильно. Слабое развитие древесины особенно бросается в глаза в штамбе, где в годы инфекции годовые кольца роста бывают чрезвычайно узкими, а в некоторых секторах сведены до толщины одной клетки. Ткани, которые должны одревесневать, обычно не твердеют. Эти особенности объясняют каучукоподобный характер побегов, а также их склонность обламываться.

Рис. 97. Золотистое пожелтение. Если заражение происходит после того, как начали формироваться ягоды, плоды сорта Бако 22А сморщиваются и опадают при малейшем толчке
Субфеллодермальный слой образуется значительно ближе к внутреннему слою флоэмы, чем нормально. Часто этот слой меристемы даже не виден и заметно только утоньшение клеточных мембран.
Все эти разнообразные признаки связаны более или менее прямо с развитием желтоватых некрозов во внешней части флоэмы. В последнее время эти некрозы подверглись более детальному исследованию [56]. На некротизированных участках, так же как и на участках с другими гистологическими симптомами, очень рано можно заметить первичную флуоресценцию.
в) Симптомы при заражении в комплексе с другими вирусами. При одновременном присутствии на одном и том же штамбе вирусов золотистого пожелтения, скручивания листьев, короткоузлия и желтой мозаики винограда все специфические особенности симптомов ЗП сохраняются отчетливо. Однако лозы, пораженные короткоузлием, бывают менее восприимчивы к ЗП, чем здоровые. Они поражаются позднее, и болезнь реже принимает характер эпифитотии; кроме того, у них совершенно отсутствуют системные симптомы и поражаются только немногие побеги, обычно группами.
Возбудитель. Золотистое пожелтение - вирусная болезнь. Она может передаваться прививкой, но никакого возбудителя - паразита, гриба и бактерии - обнаружить или выделить не удалось. Это заключение подтвердилось открытием насекомого-переносчика - цикадки Scaphoideus littoralis Ball.
Как и большинство вирусов, передающихся через цикадок, вирус ЗП не передается механически и в электролном микроскопе не виден*.
*(Заключение о невидимости вирусов этой группы в электронном микроскопе устарело. - Прим. ред. )
Возбудитель ЗП очень чувствителен к высокой температуре. Помещение больных побегов на 72 ч в воду с температурой 30°С обеспечивает снижение инфекционности на 83%.
г) Выздоровление и локализация симптомов. Даже в масштабах эпифитотии эта болезнь выделяется среди вирусных болезней растений в двух отношениях: больные лозы выздоравливают после проявления у них симптомов болезни, и часто поражаются только определенные побеги.
Выздоровление обычно наблюдается во всех виноградниках, поражаемых эпифитотиями ЗП. Там, где не происходит повторной инокуляции переносчиками, выздоровление носит полный и окончательный характер, и древесина теряет все следы инфекционное™.
Поэтому естественно спросить, в чем заключаются различия между здоровыми и выздоровевшими растениями. Когда растение, свободное от вируса, впервые инокулируют вирусом ЗП, на нем появляются системные симптомы, и наступает состояние, носящее название кризиса. Если выздоровевшие кусты подвергаются повторной инокуляции, симптомы локализуются на небольшой группе побегов, и это состояние называется рецидивом. Разумеется, несколько инокуляций, из которых каждая вызывает появление локализованных симптомов, могут придать растению вид системно зараженного; этим объясняются различия в частоте поражения, которые можно наблюдать в группе лоз, перенесших рецидивы.
Любопытный антагонизм существует между золотистым пожелтением и короткоузлием. У лоз, зараженных короткоузлием, симптомы пожелтения проявляются менее часто, чем у здоровых, и первичная инокуляция (кризис) вызывает только локализованные симптомы.
Поэтому можно сказать, что симптомы ЗП образуются на небольших группах побегов, которые поражаются по всей длине в двух случаях: если лоза уже заражена короткоузлием или если она пострадала от более ранней инвазии ЗП. Таким образом, распространение вируса ЗП в растении сдерживается, по-видимому, неспецифичной защитной реакцией, возникающей в. том случае, если растение уже было поражено вирусом ЗП или вирусом короткоузлия.
Защитная реакция растения на заражение ЗП возникает при проявлении болезни, она пропорциональна силе поражения и медленно пропадает после исчезновения инфекционного агента. Очевидно, в этих условиях реакция должна быть особенно сильной в момент ее проявления и должна действовать как барьер, преграждающий путь не только более поздним заражениям, но и тому возбудителю, который первый ее вызвал. Поэтому защитная реакция, спровоцированная ЗП, может объяснить, по-видимому, факты выздоровления.
Передача. а) Способы. Золотистое пожелтение можно передавать прививкой или через цикадку Scaphoideus littoralis. Опыты по передаче вируса через цикадок Empoasca flavescens Fab., Eusce-lis plebejus (Fall.), Macrosteles sexnotatus (Fall.) и Philaenus spumarius L. не дали положительных результатов.
б) Условия, обеспечивающие передачу вируса прививкой. Больные побеги нельзя использовать для опытов по передаче вируса прививкой как зелеными, так и одревесневшими черенками. Для этих целей используют обычно черенки, лишенные симптомов, но взятые с больных кустов. В условиях эпифитотии, когда выздоровление и реинокуляция следуют друг за другом, черенки, нарезанные зимой, способны передавать болезнь лишь в том случае, если она была повторно инокулирована переносчиком в предшествующее лето (т. е. способна сама проявить симптомы болезни следующим летом). Поскольку невозможно гарантировать, что взятые черенки были фактически реинокулированы, то практически никогда не удается добиться 100%-ной передачи болезни.
В опытах с передачей ЗП прививкой необходимо также использовать древесину, свободную от всех других вирусных болезней. Об антагонизме между ЗП и короткоузлием уже упоминалось выше.
Трудность работы со скручиванием листьев заключается в том, что недостаточно опытный наблюдатель может спутать эту болезнь с ЗП. Наилучшим критерием в таком случае нередко является невызревание древесины при золотистом пожелтении.
в) Взаимоотношения между переносчиком, вирусом и растением. Известен только один переносчик вируса ЗП - цикадка Scaphoideus littoralis. Единственным ее растением-хозяином является Vitis. Цикадка имеет одно поколение в год и зимует в стадии яиц, которые она откладывает обычно в толщу коры штамбов, ветвей и побегов в возрасте старше одного года.
Связь вируса с переносчиком относится к персистентному типу. В экспериментальных условиях переносчик воспринимает вирус за 4 - 7 дней. Латентный период вируса в переносчике при самом коротком периоде восприятия составляет около четырех недель. Способность инокулировать насекомое может сохранять в течение всей своей жизни. На экспериментально зараженных молодых лозах Бако 22А симптомы развиваются через 2 - 2 1/2 месяца. Но небольшая часть лоз остается бессимптомной до следующей весны. Для более старых растений в полевых условиях это замедленное проявление симптомов является, по-видимому, общим правилом, из которого имеются исключения.
Распространение в естественных условиях. Распространение вируса ЗП в природе точно установлено только на юго-западе Франции, где встречается S. littoralis. Как нимфы, так и взрослые насекомые могут воспринимать и передавать инфекцию, но передача через взрослых цикадок более опасна и эффективна. Эта цикадка является уроженкой Северной Америки. Там она обнаружена всего лишь в штатах Иллинойс [91], Нью-Йорк, Огайо и Мичиган [300] и найдена также в Канаде [15]. Однако сообщения о золотистом пожелтении из этих областей отсутствуют. В Калифорнии Scaphoideus littoralis, по-видимому, не встречается.
Фактически установленная область распространения болезни в Европе охватывает большинство зон, где происходят вспышки размножения вируса, и включает все департаменты Южной Франции, некоторые районы Италии и Швейцарии. В зараженных ЗП районах Бургундии, департамента Юра или ФРГ цикадка еще не обнаружена. Переносчик может распространяться при перевозке посадочного материала, несущего на себе зимующие яйца, но трансовариально болезнь, вероятно, не передается.
Вспышки на юго-западе Франции отражают свободное размножение 5. littoralis при отсутствии химической борьбы. В тех зараженных ЗП районах (Бургундия, Юра, ФРГ), где цикадка еще не обнаружена, болезнь не достигает масштабов эпифитотии. В таких случаях причиной заболевания может явиться какой-либо еще не известный относительно слабо подвижный переносчик.
Меры борьбы. Непосредственная борьба с переносчиком дает, по-видимому, эффективные результаты в силу высокой специфичности насекомого для Vitis. Существование только одного поколения в год и высокая чувствительность S. littoralis к определенным инсектицидам облегчает ее уничтожение. Эффективные результаты дают ДДТ, паратион (этил или метил), севин, диметоат и формотион* [55, 57]. Три последовательных опрыскивания, проведенных против нимфальных стадий, уничтожают популяцию переносчика прежде, чем насекомое приобретет инфекционность. Однако непременным условием успеха является истребление цикадки на больших площадях, позволяющее избежать перезаражения и реинокуляции обработанных виноградников крылатыми формами цикадки, прилетающими из виноградников, где борьба не проводилась. При отсутствии такой возможности требуются другие защитные опрыскивания. Обработки инсектицидами оказывают не только профилактическое, но и лечебное действие, так как при отсутствии угрозы реинокуляции кусты, зараженные ЗП, способны выздоравливать. Рекомендуется также выкорчевка диких лоз и самосева для уничтожения возможных "резерваций" как насекомого, так и вируса.
*(В СССР применение ДДТ, паратиона и севина запрещено; препараты диметоат и формотион не применяются. - Ред.)
Опасность завоза насекомого и (или) вируса на импортируемых побегах можно избежать, соблюдая следующие меры предосторожности: 1) ввоз только побегов текущего года, на которых кладки яиц S. littoralis или отсутствуют, или встречаются в незначительных количествах; 2) тепловая обработка побегов путем погружения их по крайней мере на 72 ч в воду с температурой 30°С. Такая обработка снижает инфекционность примерно на 83% и особенно рекомендуется для сортов, восприимчивых к ЗП; 3) карантинные мероприятия, обследования, повторные обработки инсектицидами и уничтожение всех подозрительных растений в питомниках.
Обнаружение и идентификация. Золотистое пожелтение можно обнаружить при помощи прививки или передачи переносчиком на восприимчивые лозы, о которых упоминалось выше. На них появляются очень характерные симптомы, которые нельзя спутать с симптомами любой другой болезни винограда.
ОПРОБКОВЕНИЕ КОРЫ (GRAPE CORKY BARK)
Синонимы. Rough bark; suberosi corticale; plutavost lubja.
История и географическое распространение. Эту болезнь впервые обнаружил в 1954 г. на сортах Паломино и Птит Сира Хьюитт [156], давший ей название шероховатость коры ("rough bark"). В 1959 г. в Дэвисе, Калифорния, вирус был передан прививкой гибриду LN-33 (Курдерк 1613ХБессемянный Томпсона) от зараженных кустов сортов Кариньян, Коломбар и Гренаш, на которых не было явных симптомов опробковения коры [21, 166].
Хотя впервые болезнь была описана в Калифорнии, происхождение ее не известно. В Калифорнии это наиболее распространенное заболевание винных сортов в виноградниках на океанском побережье, но инфекция была также обнаружена на винограде в долине Сан-Хуакин. Зараженные лозы имеются в Мексике. В Северную Италию [139] болезнь была перенесена прививкой, и лозы со сходными симптомами были отмечены в Югославии [2]. В Южной Африке она была передана прививкой от лоз, лишенных явных признаков заболевания, сорту-индикатору LN-33.
Экономическое значение. Поскольку вирус опробковения коры может быть бессимптомным на некоторых сортах в промышленных виноградниках, определить фактические потери очень трудно. Зараженные лозы часто бывают менее мощные, чем здоровые, даже если на них и не заметно специфических симптомов опробковения коры. Часть потерь, приписываемых другим вирусным болезням, фактически может быть обусловлена опробковением коры, поскольку последнее может быть компонентом комплекса инфекции скручивания листьев или короткоузлия на одном и том же кусте. На лозах, имеющих полевые симптомы, урожай полностью погибает. В долине Напа (Калифорния) в блоке сорта Мондёз симптомы опробковения коры были обнаружены у 8% кустов.
Круг растений-хозяев. Болезнь встречается только на винограде. Попытки передать вирус инокуляцией отжатым соком травянистым тест-растениям окончились неудачей. Опыты по передаче болезни прививкой сближением другим хозяевам, кроме винограда, также не дали результатов.
Индексирование показывает, что опробковение коры встречается на некоторых сортах Vitis vinifera и V. rupestris. Болезнь была передана нескольким гибридам Vitis. На межвидовом гибриде LN-33, в родословной которого имеются V. vinifera, V. labrusca, V. riparia (valpina) и V. candicans, симптомы бывают выражены особенно сильно. Другие гибриды со сходной родословной при инокуляции заражались, но были менее восприимчивы к вирусу, чем LN-33.
Симптомы. а) У многих сортов vinifera никаких симптомов опробковения коры, кроме ослабления мощности роста, не наблюдается. Лишь у немногих, например у Паломино, Птит Сира, Мондёз, Каберне Фран и Гамэй, симптомы появляются на побегах и листьях. Распускание почек весной задерживается, и на каждой пораженной лозе после начала роста можно обнаружить один или больше мертвых сучков. Лозы склонны сгибаться книзу, тогда как кончики их бывают обращены кверху (рис. 98, А). Древесина таких лоз мягкая или каучукообразная (рис. 98, Б]. Кора у основания лоз иногда растрескивается (рис. 98, В) и в конце сезона может иметь синевато-пурпурный оттенок. Вызревание древесины протекает неправильно: пятна зеленой древесины чередуются с нормально одревесневшей тканью. Листья на зараженных кустах мелкие и уже в начале сезона начинают бледнеть; позднее у сортов с красными плодами они краснеют и закручиваются книзу, как на кустах, пораженных скручиванием листьев. На кустах, пораженных опробковением коры, листья не опадают нормально, а сохраняются на 3 - 4 недели дольше, чем на здоровых. На некоторых зараженных лозах наблюдается мелкоплодность ("shot" berries), но не установлено, является ли она симптомом заболевания.

Рис. 98. Типичные признаки опробковения коры виноградной лозы. А - зараженный взрослый куст сорта Птит Сира в начале осени; Б - побег того же куста с мягкой (каучукоподобной) древесиной и S-образным типом роста; В - отрезок основания зараженного побега сорта Птит Сира с трещинами на коре; Г - индексирование опробковения коры на LN-33 (слева - две здоровые лозы; четыре лозы справа были за 15 месяцев перед тем инокулированы вирусом путем окулировки вприклад; вторая из этих четырех лоз погибла от болезни); Д - листья LN-33 (слева - здоровый лист, в центре - зараженный, вид сверху; справа - зараженный, вид снизу); Е - проявление у основания побега индикатора LN-33 реакции на заражение вирусом опробковения коры
На сорте Кариньян (V. vinifera) симптомы опробковения коры образуются только на листьях. В течение всего вегетационного периода молодые листья на кончиках пораженных лоз окрашены в светло-желтый цвет. Весной эти симптомы можно легко спутать со сходными симптомами, присущими желтой мозаике. Однако симптомы желтой мозаики постепенно исчезают в течение лета, тогда как симптомы опробковения коры сохраняются. Сходные симптомы пожелтения листьев наблюдаются иногда на кустах сорта Птит Сира, зараженных опробковением коры.
На большинстве сортов vinifera опробковение коры симптомов не вызывает. Обнаружение его зависит от результата индексирования с использованием LN-33.
б) На сортах-индикаторах. На LN-33 болезнь вызывает очень сильно выраженные симптомы. Рост кустов обычно сильно подавлен (рис. 98, Г). Листья мельче нормальных, с течением времени краснеют и склонны поникать (рис. 98, Д). Кора на лозах толстая, губчатая, мягкая и часто расщепляется в продольном направлении. Ткани трескаются, затем края их заживают, и по мере роста побегов на них образуются грубые продольные трещины (рис. 98, Е).
Побеги не вызревают или вызревают неравномерно и делаются мягкими или "каучукоподобными". Симптомы развиваются сначала у оснований лоз, которые вздуваются и часто покрываются глубокими трещинами, в то время как на верхушках симптомы могут отсутствовать.
С течением вегетационного периода симптомы распространяются.
Побеги, развивающиеся на инокулированных кустах, обычно отмирают в течение первой или второй зимы после инокуляции, и в следующем году из базальных почек могут не развиться новые побеги. Но если побеги развиваются, симптомы опробковения коры на них выражены слабее первоначальных.
Возбудитель. Сведения о морфологии, физических свойствах или серологии вируса отсутствуют.
Передача. Болезнь легко передается окулировкой вприклад, прививкой зеленым черенком или сближением на LN-33. При прививке зеленым черенком симптомы могут развиться через месяц после инокуляции. После окулировки вприклад они развиваются через 3 - 15 месяцев.
Сортам-индикаторам V. vinifera болезнь труднее передается окулировкой вприклад, чем LN-33, а симптомы на V. vinifera развиваются не ранее чем через 18 месяцев после инокуляции.
Распространение в естественных условиях. Переносчик вируса опробковения коры не обнаружен. Случайный характер встречаемости болезни в промышленных виноградниках показывает, что болезнь может распространяться с зараженным посадочным материалом. Из черенков, нарезанных с больных кустов, развиваются больные растения.
Полевые наблюдения показывают, что болезнь может в некоторые годы распространяться, но картирование пораженных кустов, проведенное в течение четырех лет, не подтвердило факт такого распространения. Продолжаются поиски возможного переносчика.
Меры борьбы. При слабом естественном распространении или полном его отсутствии с болезнью можно легко бороться, используя для посадки или пересадки виноградников сертифицированный материал, свободный от вируса опробковения коры. Элитный блок виноградной лозы в Калифорнийском университете (Дэвис) содержит лишь сертифицированный посадочный материал.
Терапия. Из всех вирусов, поражающих виноград в Калифорнии, вирус опробковения коры отличается наивысшей устойчивостью к высокой температуре. Он может быть инактивирован в некоторых верхушках побегов с зараженных лоз, выдержанных в течение 98 дней и дольше в камере при температуре 38°С.
Примечания. Анатомические исследования показали, что в зараженных лозах гибрида LN-33 болезнь оказывает влияние на функции камбия, образующего ксилему и луб. Из зачатков камбия образуются клетки, которые не одревесневают ни с флоэмной, ни с ксилемной стороны камбия. Образование ксилемы катастрофически уменьшается, в то время как вторичной флоэмы образуется ненормально много.
Болезнь вызывает пролиферацию ткани в сердцевинных лучах побега. Клетки этой ткани имеют неправильную форму и крупные ядра; они делятся нерегулярно, и напоминают опухолевые клетки. В некоторых случаях можно наблюдать аномальный рост и изолированные элементы сосудов. Это, вероятно, указывает на близость вируса опробковения коры к вирусу раневых опухолей, который вызывает сходный тип роста в пораженных растениях-хозяевах [181].
Обнаружение и идентификация. Лучшим способом идентификации инфекции вируса опробковения коры является индексирование, для которого растения-индикаторы сорта LN-33 инокулируют прививкой подозреваемой лозы. Для тех немногих сортов vinifera, на которых имеются явные симптомы, наиболее характерны трещины у основания лоз и голубовато-пурпурный оттенок на поверхности коры. У таких сортов болезнь можно очень легко определить осенью, вскоре после первых морозов, убивающих листья. С кустов, зараженных опробковением коры, листья не опадают в нормальные сроки, а остаются на них в течение 3 - 4 недель после опадения листьев с здоровых кустов или с кустов, пораженных только скручиванием листьев или другими вирусами.
СКРУЧИВАНИЕ ЛИСТЬЕВ (GRAPE LEAFROLL)
Синонимы. White Emperor disease; Rollkrankheit; Blattroll-krankheit; enroulement foliaire; accartocciamento; enrollamiento de la hoja; zavijanje listov.
История и географическое распространение. Упоминания о поражении винограда болезнями типа скручивания листьев появились в немецкой и французской литературе с половины XIX в. Шой [248] доказал вирусную природу болезни. Через 10 лет после него Хармон и Снайдер [151] установили, что болезнь сорта Уайт Имперор, в течение многих лет известная в Калифорнии, вызывается вирусом. Го-хин и др. [136] объединили скручивание листьев с болезнью сорта Уайт Имперор и дали ей более раннее название "скручивание листьев".
Болезнь распространена в США, Европе, Южной Африке, Австралии, Новой Зеландии, Мексике, Южной Америке и всюду, где выращивают виноград на западноевропейских подвоях. Она поражает гибридные сорта и американские сорта винограда с плотной кистью на севере и на востоке США и Канады, а также сорта viniferа в Калифорнии и Аризоне.
Экономическое значение. Болезнь снижает урожай и качество винограда. Она постепенно уменьшает размер куста, снижая, таким образом, размер гроздей и число их на куст. Плоды с пораженных кустов содержат меньше сахара, чем со здоровых. Пониженное содержание сахара задерживает наступление съемной зрелости и сбор урожая, что, в свою очередь, снижает ценность столовых сортов, предназначенных для сбыта в свежем виде. Запоздалая уборка создает проблемы в производстве изюма солнечной сушки, а также вина, Во многих случаях окончательное содержание сахара бывает недостаточным, и ягоды приходится выбраковывать. Высокая частота встречаемости скручивания листьев служит, вероятно, одним из факторов частого отсутствия марочных вин из урожаев различных лет в виноделии Западной Европы.
Болезнь уменьшает также интенсивность пигментации плодов красных сортов винограда. Там, где сбыт красного столового винограда зависит от яркости окраски, слабая пигментация снижает ценность ягод с пораженных кустов. Интенсивность окраски красных вин также уменьшается.
Шой [248] сообщал, что потерям урожая способствует пониженная морозоустойчивость зараженных кустов. В годы с поздними весенними морозами возможны значительные потери.
Для Калифорнии вычислено, что ежегодные потери от болезни составляют около 5% общего урожая винограда.
Круг растений-хозяев. Болезнь может поражать все сорта и виды Vitis. На многих сортах подвоев болезнь симптомов не вызывает, но вирус легко обнаружить в зараженных кустах путем индексирования.

Рис. 99. Типичные признаки скручивания листьев винограда. А - общий вид зараженного куста сорта Гамэй в конце октября, Б - листья сорта Гамэй (слева - здоровый, в центре - зараженный, вид сверху; справа - зараженный, вид снизу); В - листья сорта-индикатора Мисьон (те же данные, что для сорта Гамэй); Г - лозы сорта-индикатора Бако Белый (слева - здоровая; справа - давшая положительную реакцию на заражение вирусом скручивания листьев); Д - верхушечные листья сорта Бако Белый (слева - здоровый, справа - больной); Е - грозди с соседних кустов сорта Имперор (слева - с куста, пораженного скручиванием листьев; видна измененная окраска ягод; справа - со здорового куста)
Симптомы. Симптомы скручивания листьев варьируют в зависимости от сорта, условий окружающей среды и времени года. Весенние симптомы на кустах vinifera выражены неясно, но больные кусты обычно мельче здоровых, и листья на них появляются позднее. На неорошаемых виноградниках симптомы появляются на листьях в начале июня, а на орошаемых - не раньше августа. Листья закручиваются книзу и, начиная с нижних, постепенно краснеют, но жилки сохраняют зеленую окраску в течение всего сезона (рис. 99, А). У оснований побегов листья скручиваются книзу, а у сортов с темноокрашенными ягодами на них начинают краснеть участки между главными жилками (рис. 99, Б). На инокулированных кустах сорта Мисьон симптомы на листьях выражены очень отчетливо, поэтому данный сорт является хорошим индикатором скручивания листьев (рис. 99, В). На сортах со светлоокрашенными ягодами симптомы выражены слабее, но закручивание листьев книзу, сопровождающееся развитием межжилкового хлороза, обычно хорошо заметно. У нескольких сортов, например у Бессемянного Томпсона и Перлетт, скручивание выражено очень слабо, но в конце лета на листьях между главными жилками появляются участки побуревшей ткани (ожоги).
Гибрид винограда с плотной кистью Бако Белый (Бако 22А) широко используется в Калифорнийском университете для индексирования других сортов, так как он отличается крайне высокой восприимчивостью к скручиванию листьев. Если небольшие растения, выращенные в теплице, инокулировать весной окулировкой в приклад, то через шесть недель после пересадки в полевой питомник на них появляются ясно выраженные симптомы. Рост зараженных индикаторных растений сорта Белый Бако бывает сильно подавлен, листья на них мелкие, и пластинка образует острый угол с черешком в месте прикрепления; на молодых листьях на верхушках лоз или боковых побегов часто наблюдается межжилковый хлороз (рис. 99, Г и Д).
По мере созревания симптомы заболевания начинают проявляться на ягодах. На пораженных кустах всех сортов грозди бывают мельче, число их на куст уменьшается, содержание сахара снижено. На окраску черноплодных сортов болезнь влияет мало, но на красноплодных сортах (Кардинал, Имперор, Мисьон, Куин, Красная Малага, Токай) к моменту сбора ягоды не достигают нормальной красной окраски (рис. 99, Е). Подобное отсутствие окраски у сорта Имперор привело к возникновению названия "Белый Имперор". На зараженных кустах белых сортов [Милон, Рислинг, Сильванер и Бессемянный Томпсона (Султана)] ягоды к моменту сбора приобретают желтовато-белую, а не нормальную зеленовато-белую окраску.
Существуют и внутренние различия. Основным внутренним симптомом скручивания листьев является дегенерация флоэмы в побегах, черешках, листьях, ножке грозди и плодоножках. Элементы ситовидных трубок, сопровождающие клетки и лубяная паренхима отмирают и исчезают. Дегенерация флоэмы начинается рано, и ее можно обнаружить до появления внешних симптомов на листьях. В тканях штамба и листьев образуются трабекулы, а в черешках на зараженных кустах - тиллы. Содержание калия и кальция в листовых пластинках зараженных кустов значительно ниже, чем у здоровых растений; по-видимому, калий накапливается в черешках пораженных растений [77]. В листовых пластинках пораженных кустов накапливается крахмал.
Симптомы заболевания на сортах labrusca и гибридов американского винограда с плотной кистью несколько отличаются от симптомов, характерных для группы vinifera. Рост больных кустов labrusca и гибридов этого вида бывает подавлен по сравнению с ростом здоровых. Листья на пораженных кустах скручены слабо; в конце лета по краям и на участках между главными жилками появляется ожог (побурение). Содержание сахара низкое, а у красно-плодного гибрида Бронкс ягоды остаются бесцветными, как у сорта Имперор.
На сортах подвоев, происходящих в основном от других видов Vitis, чем V, vinifera или V. labrusca, симптомы скручивания листьев не проявляются, хотя эти сорта часто несут вирус.
Возбудитель. Скручивание листьев вызывается вирусом, но из тканей винограда он не был выделен.
Передача. Вирус не был передан другим хозяевам, помимо винограда. Его нельзя механически передать от одного растения винограда другому путем инокуляции отжатым соком. Сортам Мисьои и Белый Бако он легко передается окулировкой в приклад, у сорта Мисьон характерные симптомы заболевания могут образоваться на листьях в течение первого же вегетационного периода, но присутствие слабых штаммов вируса может проявиться только примерно через 18 месяцев после инокуляции. На Белом Бако слабые штаммы обычно симптомов не вызывают, но умеренно сильные или сильные штаммы образуют симптомы примерно через 2 - 3 месяца после инокуляции.
Распространение в естественных условиях. Естественное распространение скручивания листьев в Калифорнии не установлено. Контрольные тесты не обнаружили присутствия переносчика вируса скручивания листьев. В почве инфекция не сохраняется, поэтому нет оснований считать, что переносчиком может служить какой-либо почвенный организм.
Тот факт, что некоторые сорта подвоев являются бессимптомными носителями вируса скручивания листьев, привел к широкому распространению болезни. Встречаемость ее во многих виноградниках Калифорнии и в других районах мира очень высокая. При закладке новых виноградников болезнь усиливается, если привои и подвои используются беспорядочно, без отбора здоровых маточных кустов.
Меры борьбы. Использование незараженного посадочного материала предупреждает поражение скручиванием листьев новых или пересаженных виноградников. Если сертифицированные растения винограда получить не удается, необходимо при отборе материала провести до нарезки черенков очень тщательное обследование маточных кустов. При использовании многих сортов, у которых симптомы болезни неясные или совсем отсутствуют, получение незараженного посадочного материала можно гарантировать только при условии проведения программы индексирования.
В результате проведения программы, включающей отбор, термотерапию и индексирование, в Дэвисе (Калифорния) при осуществлении объединенного проекта Министерства сельского хозяйства США и Калифорнийского университета была создана элитная плантация (foundation planting) сортов и подвоев винограда, свободных от скручивания листьев и других известных вирусов винограда. Владельцы питомников могут получать в этом винограднике материал для производства сертифицированного посадочного материала. Служба питомников Департамента сельского хозяйства штата Калифорния наблюдает за производством в питомниках чистого, незараженного посадочного материала и за его сертификацией.
Терапия. Тепловая терапия применяется для получения клонов, свободных от скручивания листьев, от материнских кустов, пораженных этой болезнью. При выдерживании зараженных кустов в камере при 38°С и дополнительном освещении зараженные лозы продолжают расти и образовывать побеги. Верхушки таких побегов длиной до 5 см можно освободить от вируса скручивания листьев, выдерживая растения при указанной температуре в течение 56 дней или дольше. Верхушечные черенки длиной 2 - 5 см, нарезанные из верхушек таких побегов, можно окоренять в условиях искусственного тумана и получать из них новые растения. Проверка индексированием показала, что 86% растений, полученных таким способом от зараженных материнских кустов, не содержали вируса скручивания листьев.
Примечания. Хотя эффективный естественный переносчик вируса скручивания листьев не известен, но эта болезнь наиболее широко распространена в Калифорнии среди других вирусных болезней винограда. Это объясняется двумя причинами: 1) вирус не создает заметных препятствий для размножения винограда, поэтому не происходит естественного удаления растений, зараженных скручиванием листьев; 2) на сортах подвоев винограда болезнь не вызывает симптомов, однако они могут быть заражены ею.
До 1955 г. отбор растений, не зараженных скручиванием листьев, в промышленном виноградарстве не проводили, хотя Шой [248] рекомендовал выбраковывать зараженные лозы и указывал, что использование незараженного посадочного материала значительно увеличит продуктивность винограда.
Невозможность избежать заражения вирусом скручивания листьев, даже при выведении новых сортов, совершенно очевидна. Несколько таких новых сортов, выпущенных за последние 30 лет, были первоначально привиты на подвои, зараженные скручиванием листьев; соответственно весь полученный посадочный материал содержал в себе инфекцию. Фактическую продуктивность этих сортов необходимо еще определить точнее. В последнее время чистый материал стали получать, применяя термотерапию. Селекционеры должны быть очень осторожными и использовать для размножения новых селекционных форм и сортов только заведомо свободные от вируса клоны подвоев.
До половины XIX в. скручивание листьев имело, вероятно, очень небольшое значение в западноевропейских виноградниках, если вообще там встречалось. Но после того как для борьбы с филлоксерой потребовались устойчивые подвои, некоторые из них по недосмотру оказались зараженными скручиванием листьев; начиная с этих растений, болезнь распространилась и усилилась до такой степени, что в настоящее время уже превратилась в серьезнейшую проблему виноградарства. Промышленность должна настаивать на использовании для закладки виноградников исключительно сертифицированного посадочного материала (особенно подвоев).
Обнаружение и идентификация. Для установления незараженности скручиванием листьев необходимо проводить индексирование на сорте Мисьон. На зараженных сортах подвоев симптомы отсутствуют, а на сортах привоев они могут быть, могут отсутствовать или носить неясный характер. Появление красноватых, желтоватых, скрученных или "обожженных" листьев, а также пониженную мощность кустов могут вызывать, помимо вируса скручивания листьев, и другие возбудители. Путем индексирования на сорте Белый Бако через 2 - 3 месяца можно обнаружить присутствие умеренно сильных или сильных штаммов вируса скручивания листьев, но слабые штаммы удастся обнаружить только после 18-месячного испытания их на сорте Мисьон.
На темноплодных сортах vinifera наиболее стойким симптомом скручивания листьев является закручивание листьев книзу и покраснение листовых пластинок; главные жилки остаются зелеными. Симптом образуется на базальных листьях побегов примерно в середине лета. Особенно хорошо он бывает выражен перед самыми морозами, когда на каждом кусте поражено много листьев (см. рис. 99, А).
В винограднике скручивание листьев часто смешивают с калийным голоданием. Однако последнее проявляется по времени раньше, чем скручивание листьев, и симптомы его развиваются первоначально примерно на десятом узле побега, тогда как симптомы скручивания листьев образуются в первую очередь на листьях базальных узлов [285].
ЗВЕЗДЧАТАЯ МОЗАИКА (ASTEROID MOSAIC OF GRAPEVINE)
Синонимы. Asteroid type leaf spot; mosaico stellare. Идентичность ее с европейской "mosaico" [214 - 217], настоящей (true) мозаикой [103] или прозрачной мозаикой (mosaique transparente) [34] весьма сомнительна. Австралийская fusion spot, отмеченная на сортах Шасла и Султана, по-видимому, идентична с настоящей мозаикой и является, вероятно, штаммом вируса короткоузлия.

Рис. 100. Различные типы звездчатой мозаики, перенесенной на лозы сорта Мисьон в Дэвисе (Калифорния) в 1963 г.
История и географическое распространение. Звездчатая мозаика была впервые обнаружена в Калифорнии в 1953 г., о чем сообщил Хьюитт [156]. После этого окулировкой в приклад болезнь была передана сортам Vitis vinifera: Кариньян, Имперор, Коломбар и Мисьон. Прививкой сближением ее удалось передать как этим сортам, так и сортам Бессемянный Томпсона и Вальдепеньяс. Непривитые кусты тех же сортов остались в обоих опытах здоровыми. Таким способом была доказана вирусная этиология болезни. До последнего времени сообщения об этой болезни поступали только из долины Напа в Калифорнии, но имеются указания, что звездчатая мозаика встречается и в других районах виноградарства. Симптомы, напоминающие звездчатую мозаику, были отмечены недавно в Италии и Южной Африке. В настоящее время проводится ее индексирование на индикаторных сортах винограда*.
*(Индексирование отобранных на месте кустов, проведенное на карантинной станции в Штелленбоше, подтвердило недавно присутствие звездчатой мозаики в Южной Африке, хотя только в нескольких изолированных случаях. (Личное сообщение д-ра И. Д. Вольфсвинкеля из Научно-исследовательского института виноградарства и виноделия, Штелленбош, Южная Африка.))
Экономическое значение. В зоне, где болезнь была впервые обнаружена, она встречается еще настолько редко, что экономическое значение ее пока невелико, хотя пораженные растения страдают довольно сильно. Но если переносчик (которого еще предстоит обнаружить) окажется более эффективным, то ее потенциальное экономическое значение будет весьма высоким.
Круг растений-хозяев. Вирус обнаружен в нескольких сортах Vitis vinifera и был экспериментально передан прививкой многим сортам этого вида и сорту Сент Джордж (V. rupestris). Опыты по передаче вируса соком травянистым тест-растениям до сих пор не удавались, так же как и опыты по передаче его индикаторным растениям через нематоду Xiphinema index Thome et Allen.

Рис. 101. Типичные симптомы звездчатой мозаики на листьях индикаторного сорта Сент-Джордж (Vitis rupestris): разнообразные полосы кремово-желтого цвета беспорядочно разбросаны вдоль главных жилок
Симптомы. На V. vinifera симптомы имеют вид звездообразных пятен, беспорядочно рассеянных на листовых пластинках (рис. 100). При многочисленности этих пятен они сливаются и располагаются чаще всего между первичными и вторичными жилками; в центре наиболее ясно выраженных звездчатых пятен нередко возникают некротические точки. Иногда мелкие жилки в отдельных секторах листовых пластинок или по краям их просветляются, образуя рисунок сетчатого окаймления. Листья асимметричны, скручены и сморщены по длине жилок. Краевые синусы глубоко вырезаны, и на листьях некоторых сортов появляются вздутия, имеющие нормальный зеленый цвет. В течение лета симптомы обычно несколько ослабевают. Пораженные кусты часто перестают расти и почти или совсем не плодоносят. Симптомы заболевания наблюдались на сортах Мерло, Цинфандель, Мисьон, Коломбар, Кариньян, Имперор, Бессемянный Томпсона, Вальдепеньяс и иногда на гибриде LN-33.
На сорте Сент-Джордж (V. rupestris) симптомы, получаемые при индексировании материала, пораженного звездчатой мозаикой, появляются обычно через 30 - 60 дней после инокуляции и выглядят следующим образом: на листьях вдоль крупных жилок беспорядочно располагаются кремово-желтые полосы, с неровными, слегка зазубренными краями; листья скрученные, с волнистыми краями, принимают постепенно асимметричную форму (рис. 101); на более молодых листьях возможно посветление мелких жилок; на второй год на более старых листьях могут появиться некротические пятна.
Возбудитель. Данные о морфологии, свойствах и серологических взаимоотношениях вируса отсутствуют.
Передача. Вирус передавался только прививкой нескольким сортам V. vinifera и сорту Сент-Джордж V. rupestris.
Распространение в естественных условиях. Сведения отсутствуют.
Терапия. Сведения отсутствуют.
Обнаружение и идентификация. Диагностировать болезнь можно по характеру симптомов, появляющихся при индексировании на сорте Сент-Джордж.
НЕКРОЗ (NECROSIS OF THE GRAPE)
Синонимы. Отсутствуют.
История и географическое распространение. Некроз листьев винограда, особенно у посадочного материала, был отмечен у гибрида Кобер 5ВВ (V. berlandieriXV. riparia), Порталис (V. riparia) и позднее в более слабой степени у гибрида V. Riparia V. rupestris. Некроз наблюдался в нескольких районах виноградарства Чехословакии с различной частотой встречаемости, но при явной тенденции к распространению.
Впервые о некрозе винограда сообщили Квичала и Пфейферова [180]. По данным этих работников, в Моравии болезнь была известна уже в течение нескольких лет. Она распространяется кругами, что говорит о ее вирусном происхождении. Некроз успешно передавался прививкой, вызывая появление симптомов на привитом кусте. Частота встречаемости некроза в виноградниках очень различна. В некоторых местах симптомы отмечались только на отдельных растениях, тогда как в других некрозом было поражено 25 - 30% растений.
Круг растений-хозяев. В ходе дальнейших исследований и тщательных поисков этой болезни дополнительные случаи ее были обнаружены в Моравии и Словакии [286, 287, 288].
Симптомы. В результате нескольких лет исследований и наблюдений над заболевшими растениями Фик [108] составил детальное описание болезни. Симптомы ее можно разделить на четыре стадии.
1. Первым признаком болезни служит асимметрия листа, хотя она наблюдается не всегда и не является обязательным специфическим симптомом инфекции. Такая асимметрия листа может наблюдаться в течение многих лет подряд до появления следующих стадий симптомов.
2. Во второй стадии симптомов между жилками второго и третьего порядка появляются зеленовато-желтые пятна, неправильной округлой или эллипсоидной формы, которая определяется жилками (рис. 102). Эти пятна постепенно переходят в зеленую ткань, окаймляющую жилки. Обесцвечивание ткани ясно видно в проходящем свете; интенсивность его различна. Образование пятен не меняет характера жилок, как это наблюдается при повреждении листьев клещами. Вторая стадия симптомов наблюдается не рано весной, а позднее, в июне или июле, в зависимости от ритма роста. Вторую стадию симптомов можно наблюдать на одном и том же растении в течение нескольких лет подряд, пока не возникнет наконец некроз пятнистых частей листьев (третья стадия симптомов).
3. Основной признак третьей стадии симптомов - некроз обесцвеченной листовой ткани (рис. 103, вверху). Некротизированная ткань обламывается и выпадает (рис. 103, внизу), в результате чего от листьев нередко сохраняются только черешки и главные жилки, с последними связаны остатки окружающей ткани, которая в стадии образования пятен была еще зеленой.

Рис. 102. Признак второй стадии симптомов: пятнистость
4. В четвертой стадии симптомов значительная потеря ассимилирующей поверхности задерживает общее развитие и рост растения. Кусты получаются слабые, и при благоприятствующих развитию болезни условиях длина однолетних побегов часто не превышает 100 см. У сортов виноградных подвоев междоузлия укорочены, хотя так называемая зигзагообразность (angle disease) междоузлий не проявляется. Не были отмечены также короткие или вилкообразные междоузлия, характерные для короткоузлия винограда. Зараженные кусты не образуют избыточных побегов, как в случае "ведьминых метел", но с каждым годом на них развивается все меньшее число побегов, что в конце концов приводит их к гибели.
Некроз был отмечен также и на европейских сортах Vitis vinifera (например, Нейбург, Франковка, Хрупка, Синий Португальский и Мускат Оттонель). Симптомы, появляющиеся на европейских сортах, сходны с симптомами на подвоях, хотя урожаи снижаются значительно. На гибридах винограда также развиваются типичные стадии симптомов.
Некоторые симптомы, имеющие физиологическое происхождение или вызванные другими патогенами, напоминают симптомы некроза [286 - 288].
Вторая стадия симптомов некроза по внешнему виду напоминает симптомы недостаточности цинка [156]. Недостаточность цинка выражается в образовании мелких листьев и различной степени межжилкового хлороза. В этом состоит основное различие, так как третья стадия симптомов отличается некротизацией и потерей листовой ткани. Вторая стадия симптомов напоминает также первые признаки калийного голодания, проявляющиеся в форме межжилко-вого некроза [269, 287]. Прогрессирующие симптомы недостаточности (бурые пятна и некротические поражения краев листьев) отличаются от третьей стадии симптомов некроза.
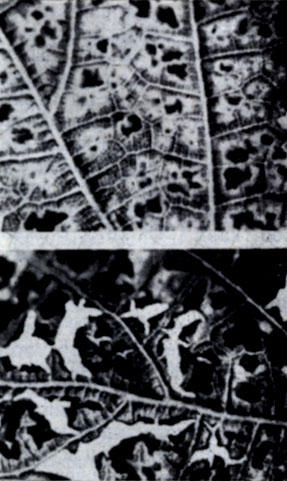
Рис. 103. Вверху - признак третьей стадии симптомов: некротизированная ткань; внизу - более поздний вид той же стадии выпадения поврежденной ткани
Симптомы недостаточности магния (рис. 104) до некоторой степени напоминают третью стадию симптомов (некроз ткани), но им не предшествуют типичные симптомы первой и второй стадии. Не-кротизированные части четко локализованы в зеленой ткани в форме гирлянды или беспорядочно разбросанных участков межжилковой ткани [269, 287]. В ткани развиваются только мелкие поражения, и потери ее гораздо меньше, чем при некрозе. Подробные данные по всем минеральным веществам приведены Чепменом [77].
Симптомы, сходные с симптомами некроза, вызывает паутинный клещик (Tetranychus urticae) [81]. Этот клещ вызывает на поврежденных частях листьев появление светлых пятен неправильной формы. При сильных повреждениях пятна сливаются, создавая картину, несколько напоминающую вторую стадию симптомов некроза. На сильно поврежденных листьях жилки искривляются, и пластинки сморщиваются. При культуре винограда в теплице эти симптомы бывают выражены очень заметно (рис. 105). Но на открытом воздухе листья деформируются, и симптомы сильно отличаются от симптомов некроза.
При повреждении винограда другим клещом (Phyllocoptes vitis) на листьях появляются светло-зеленые пятна [268].

Рис. 104. Симптомы недостаточности магния

Рис. 105. Вверху - листья, поврежденные паутинным клещиком (Tetranychus urticae). Внизу - деталь того же повреждения
Передача. Инфекционная природа некроза винограда доказана различными методами, и прежде всего вегетативным размножением при использовании черенков с больных растений. На некоторых черенках, выращиваемых в различных местностях, симптомы развивались в первом же году [109]. Однако вряд ли каждый глазок больного растения будет содержать вирус в одной и той же концентрации. Некроз винограда передается также прививкой [109, 180].
Распространение в естественных условиях. Некроз винограда, распространяясь кругами, при благоприятных для развития болезни условиях может за 5 - 10 лет стать угрозой для производства посадочного материала. Зараженные растения ослабевают и постепенно вырождаются. Черенки с больных маточных лоз хуже окореняются и могут распространять некроз в новых районах.
Меры борьбы. Бороться с болезнью можно путем ежегодного инспектирования маточного и селекционного материала в виноградниках и выбраковки больных и подозрительных растений [24]. Для новых посадок следует использовать черенки из местностей, абсолютно свободных от вируса, или же нужно проверять посадочный материал. При использовании европейских сортов винограда рекомендуется отбирать здоровые маточные растения. Не следует брать материал для прививок черенками или глазками из местностей, в которых распространен некроз.
Обнаружение и идентификация. Очень важный признак вируса некроза винограда - его длительный латентный период. По данным автора, латентное состояние может длиться от 10 до 12 лет, а в некоторых случаях и дольше.
В одном старом кусте винограда вирус сохранялся без симптомов свыше 20 лет. И только так называемый "провокационный тест", примененный в отношении черенков с этого куста, вызвал появление типичных некротических симптомов.
Разное проявление симптомов некроза изучалось на многих питательных средах. Изменение состава таких сред может провоцировать или, наоборот, маскировать симптомы болезни. Так, полный питательный раствор ван дер Кроне провоцировал появление симптомов некроза, но такие же симптомы появлялись на средах, лишенных молибдена, магния и серы или содержащих избыток магния. Некротические симптомы маскируются в тех случаях, когда питательный раствор содержит избыток бора, меди, цинка, молибдена или некоторых других элементов [286 - 290]. (См. также у Чепмена [77] данные о недостаточности или избытке различных минеральных элементов в растениях.)

Рис. 106. Симптомы некроза, спровоцированного специальным тестом
Вышеприведенные результаты обусловили применение провокационных тестов для выявления некроза винограда в латентной стадии. Если выращивать глазки с зараженных кустов винограда (с явными симптомами или без них) на провокационных питательных растворах, на развивающихся почках и распускающихся листьях через 2 - 3 месяца появляются типичные симптомы некроза (рис, 106). Поскольку не все почки на зараженном кусте содержат вирус или же концентрация последнего может оказаться слишком низкой, для указанного теста требуется использовать 5 - 10 глазков, взятых с различных частей растения.
КОРОТКОУЗЛИЕ (FANLEAF OF GRAPEVINE)
Синонимы. Инфекционное вырождение винограда [1, 7]; degenerescence infectieuse; court-noue; arricciarnento; ReisigKrank-heit; Gabler; Krautern; curto infeccioso; urticado. Особые штаммы вируса короткоузлия вызывают симптомы недостаточности хлорофилла, обозначаемой специальными названиями: зеленая или "настоящая" мозаика ("true" mosaic); желтая мозаика (yellow mosaic) ; хромовое пожелтение (chrome-yellowing); окаймление жилок (vein banding); мозаика (mosaique); пестролистность (panachure); giallume; Mosaik; Gelbmosaik; Panaschure; mosaico amarelo.
История и географическое распространение. О симптомах, связанных с короткоузлием винограда, много лет назад упоминалось во французской, итальянской, немецкой и австрийской литературе ,[242].
Наличие на винограде очагов вируса наряду с присутствием нематоды-переносчика(Xiphinema index Thome et Allen) в местных виноградниках стран Восточного Средиземноморья (Греции [280]) 1И Западной Азии (Турции, Ирана [30, 320]) показывает, что болезнь могла существовать в этих зонах с первых лет культуры винограда. Вместе с вегетативно размноженным посадочным материалом короткоузлие и, вероятно, нематода-переносчик вируса распространились из Европы практически во все области мира, где сейчас выращивают виноград: Калифорнию, Центральную и Южную Америку, Южную Африку и Австралию. Завоз филлоксеры винограда в большинство европейских виноградников явился косвенной причиной широкого распространения короткоузлия, так же как и других вирусных болезней винограда. Этому способствовали изменения приемов культуры (прививка на гибридные подвои, расширенный обмен посадочным материалом и повторные пересадки виноградников, особенно в самых известных странах виноградарства).
В американских зонах выращивания Vitis labrusca (северо-восток США и прилегающие районы Канады), несмотря на частую встречаемость симптомов мозаики и деформаций листьев на некоторых сортах, вирус короткоузлия ни разу не был выделен из них (Диас, личное сообщение, 1965).
Отсутствуют также сообщения о нахождении вируса короткоузлия в диких популяциях североамериканских видов Vitis. Нет никаких сведений относительно Vitis в Северной и Восточной Азии.
Экономическое значение. В суровых условиях окружающей среды (маломощные почвы, жаркий и солнечный климат) короткоузлие и близкие к. нему болезни могут убивать кусты винограда. Однако пораженные лозы обычно еще долгое время остаются живыми, становясь все менее и менее продуктивными, пока наконец зараженные виноградники не забрасываются из экономических соображений. Продуктивность кустов, пораженных короткоузлием, снижается до степени, которая определяется условиями погоды в период цветения. В евоопейских странах для наиболее восприимчивых сортов Vitiы vinifera, например Шардонне, Мускат и Таминер, снижение состав^, ляет в среднем 50% от веса урожая. Кроме того, товарная ценность, столовых сортов винограда заметно падает из-за внешнего вида гроздей (осыпание и торошение ягод) с пораженных кустов. В питомниках черенки или растения, привитые черенками, древесина которых была поражена короткоузлием, отличаются более слабым ростом и пониженной способностью к окоренению; процент успешных прививок снижается.
Круг растений-хозяев. а) Древесные растения-хозяева. Все сорта V. vinifera восприимчивы; не известно ни одного устойчивого или толерантного сорта, хотя некоторые сорта поражаются слабее других.
Установлено, что все американские виды, интродуцированные в Европу, и гибриды V. labrusca, V. riparia, V. rupestris, V. berlan-dieri, V. aestivalis и V. candicans восприимчивы к вирусу короткоузлия при естественном заражении (выращивание в почве, зараженной нематодами [42], и при экспериментальной инокуляции прививкой [310]).
Декоративные азиатские виды V. davidi, V. coignetiae, V. piasez-kii, V. ishikari и плодоносные сорта V. amurensis можно легко заразить прививкой [310].
В Португалии виды Ampelopsis и Parthenocissus были экспериментально заражены вирусами короткоузлия и желтой мозаики [97]. Во Франции мозаику и желтую пестролистность, отмеченные на декоративном виде Cissus и диком винограде (Parthenocissus quinquefolia), не удалось связать с вирусом короткоузлия. (Попытки инокулировать прививкой виды Vitis успеха не имели, так же как и опыты по механической инокуляции некоторых травянистых хозяев.)
Некоторые работники указывают, что многие древесные многолетники (деревья и декоративные кустарники, например Ligustrum, Prunus, Jiiglans, Ulmus, Acer и др.) являются возможными хозяевами вируса' [10, 12, 80, 85], но это требуется доказать, выделив вирус короткоузлия из этих инокулированных им видов и снова заразив им виноград или травянистых хозяев.
б) Травянистые хозяева. Несколько травянистых растений можно экспериментально заразить вирусом короткоузлия, применив механическую инокуляцию, но в отличие от опытов с другими передающимися через почву вирусами кольцевой пятнистости ни в одном случае не удалось обнаружить естественного заражения их в полевых условиях. Некоторым сильно восприимчивым видам, например Chenopodium quinoa, С. amaranticolor, С. polyspermum ив меньшей степени Gomphrena globosa, и некоторым видам Аmаranthus можно легко передать вирус от винограда путем механической инокуляции. Вирус короткоузлия можно последовательно механически передавать от этих видов широкому кругу других видов растений [98]; некоторые из них заражаются с трудом, что зависит от отдельных штаммов вируса и от сезонных условий окружающей среды, или заражение возможно только на инокулированных листьях. В приведенном ниже списке эти виды заключены в скобки.
Chenopodiaceae: Chenopodium quinoa Wil.ld., С. amaranticolor Coste et Reyn., С polvspermum L., C. urbicum L., C. album L., C. hybridum L., C. murale L, С rubrum L., C. foetidum Schrad., C. ambrosioides L.t C. anthelminticum L., C. botrus L С vulvaria L., C. foliosum Asch., C. capitatum (L.) Asch., (C. bonus-henn-cus L"), (C. multifidum L.), (Atriplex hastata L.), (Beta vulgaris L.).
Amaranthaceae: Gomphrena globosa L., Amaranthus patulus Fion, A. panicula-tus L., A. spinosus L., A. caudatus L., (A retroflexus L.), (Celosia plumosa L.).
Cucurbitaceae: Cucumis sativus L., (C. melo L.).
Leguminosae: Phaseolus vulgaris L., (Vigna sinensis i[TornerJ Savi).
Solanaceae- Nicotina clevelandii Gray. (N. tabacum L., сорта Самсун Уайт БарлейиКсанти), (N. rustica L.), (N. debney Domin) (N. affins Hort.= N bigelovii [Torr.] Wats. var. multiualvis Lindl.), (N. digluta Hort.= N. glutitnosa L X N. tabacum L.), (N. glauca Grhm.), (N. glutinosa L.), (Petunia hybnda Vilm.).
Другие указанные в литературе виды [10], для которых идентичность перенесенного вируса точно не установлена, требуют дальнейшего подтверждения. В их число входят:
Umbelliferae: Ammi majus L.
Balsaminaeeae: Impatiens holstani Hort (I. holstu Engler et Warb. X I. sultani Hook.).
Leguminosae: Medicago sativa L.
Solanaceae: Lycopersicum esculentum Mill., L. pimpmelhfohum Dunal, Datura stramonium L.
Симптомы. а) Симптомы на листьях. Короткоузлие вызывает характерную деформацию листьев, при которой жилки ненормально, расходятся веером (рис. 107). У некоторых сортов Vitis yintfera, например Мисьон (Калифорния), Шардонне (Франция), Витал (Италия), гибрид SF4 (ФРГ), Фернао Пирес (Португалия), а также у американских видов и гибридов V. rupestns и V. vulpina (ripariq); этот симптом заметен очень ясно. Но у многих сортов винограда такие деформации никогда не возникают и наблюдается только слабая асимметрия и уменьшение размера листьев.

Рис 107. Слева - деформированный лист сорта Шардонне (Vitis vinifera). Вверху справа - частично пораженный куст: один побег почти нормален. Внизу справа - общее заражение сильным штаммом вируса короткоузлия (Мерсо, Золотой Берег)
Симптомы короткоузлия появляются только в хронической ста дни болезни (вторичный симптом). Первичные симптомы на недавно зараженных кустах винограда представлены кольцевым и линейным узорами и маслянистыми пятнами на некоторых листьях (рис 108 вверху). Эти симптомы мимолетны и быстро уступают место системной зеленой или желтой мозаике (иногда в сочетании с окаймлением жилок), что может быть связано с различными степенями деформации (рис. 108, внизу).
Как и при деформациях листьев, степень выраженности симптомов мозаики различается в зависимости от штамма вируса, участвующего в заражении; иногда симптомы могут совершенно отсутствовать. Кроме того, кусты винограда с симптомами мозаики и симптомами, напоминающими короткоузлие не обязательно бывают заражены вирусом короткоузлия, как это будет показано ниже [165, 323].

Рис. 108. Вверху - первичные симптомы короткоузлия на гибриде Кобер 5ВВ (berlandieri x riparia), вызванные естественной почвенной инфекцией: слева - кольцевой и линейный узоры; справа - маслянистые пятна и кольцевая пятнистость. Внизу слева - сорт Шардонне (Vitis vinifera) с симптомами зеленой и желтой мозаики, но без деформации листьев; справа - тот же сорт с симптомами желтого окаймления жилок, связанного с короткоузлием (Кольмар, Верхний Рейн; Мерсо, Золотой Берег)

Рис. 109. Слева - плодовая кисть сорта Меслие с симптомами торошения. Справа вверху - влияние короткоузлия на продуктивность винограда: слева - урожай с зараженного куста сорта Шардонне; справа - виноград, собранный со здорового куста. Внизу справа - трабекулы в ксилемном сосуде побега сорта Кобер 5ВВ (berlandieri x riparia), зараженного короткоузлием (Кольмар, Верхний Рейн)
б) Симптомы на штамбе. У побегов на виноградных кустах пораженных короткоузлием, междоузлия короче и более неровные чем у здоровых. Усиленное развитие боковых побегов придает лозам кустистый вид. Двойные узлы и фасциации штамбов гроздей усов и черешков традиционно считаются наиболее яркими симптомами короткоузлия. Однако диагноз, основанный на этих признаках, не может считаться надежным, поскольку разбросанные двойные узлы или фасциации можно нередко наблюдать на кустах, которые долгое время растут и плодоносят нормально и при испытаниях на индикаторных сортах винограда или травянистых тест-растениях не обнаруживают заражения вирусом короткоузлия [28, 308].
в) Симптомы на плодах. Для практики самым важным симптомом короткоузлия, проявляющимся на кистях, является осыпание ягод или торошение (рис. 109). Даже очень сильные симптомы поражения ягод могут проявляться без серьезного нарушения для роста кустов или в отсутствие явных симптомов на листьях. Однако осыпание и торошение ягод отнюдь не специфичные симптомы, так как они могут появляться и при других вирусных болезнях, например при пожелтении жилок винограда, и при определенных климатических или генетических условиях: так, торошение обычно наблюдается на женских сортах Vitis vinifera.
г) Внутренние симптомы. Эндрцеллюлярные кордоны (cordoni endocellulari) Петри [218, 219], или трабекулы, представляют собой особые продукты клеточной мембраны, развивающиеся в тканях кустов, пораженных короткоузлием. Трабекулы легко обнаружить в сосудах одревесневших побегов, где они образуют стекловидные, светопреломляющие радиальные тяжи (рис. 109, внизу справа).
Образование трабекул часто связывали с инфекционным вырождением виноградной лозы (короткоузлие и желтая мозаика) [25, 178, 250, 251], хотя небольшое число трабекул еще не является достаточным доказательством заражения. Опыты с прививками показали, что у одних видов винограда (Vitis riparia, V. rupestris, V. berlandieri и их гибриды) трабекулы встречаются в большем количестве, чем у других (V. vinifera, V. labrusca) [305, 307].
Специфичность трабекул как диагностического признака корот-коузлия требует дальнейшего обсуждения, поскольку они были обнаружены также при инфекционном некрозе винограда в Чехословакии [108] и при скручивании листьев американского винограда в Калифорнии [172]. Результаты наших опытов с прививками не совпадают с данными последней работы, поскольку трабекулы развивались в больших количествах в стеблях гибрида Кобер 5ВВ (berlandieriy х riparia), индикатора, инокулированного вирусом короткоузлия, но отсутствовали при инокуляции европейским штаммом скручивания листьев [314].
д) Симптомы на индикаторных видах винограда. После инокуляции прививкой сорта Сент-Джордж (Vitis rupestris) вирусом короткоузлия на растениях появляются маслянистые пятна, мозаика и асимметричные листья. Позднее системно зараженные растения характеризуются листьями с'сильно зазубренными краями, приобретают кустистую форму и прекращают рост. В стеблях имеются многочисленные трабекулы.
По данным калифорнийских исследователей [160, 166], в течение первого года V. rupestris является хорошим индикатором, так как дает ясно различимые реакции на короткоузлие и другие вирусные болезни винограда: вирус звездчатой мозаики вызывает образование желтых полос вдоль главных жилок, тогда как вирус пожелтения жилок винограда реакции вообще не дает (V. rupestris к числу хозяев этого вируса не относится). Во Франции мозаичная болезнь, не связанная с короткоузлием, вызывает у V. rupestris скручивание листьев и межжилковую крапчатость, причем симптомы в этих случаях развиваются во времени позднее, чем симптомы короткоузлия [325]. Образования трабекул болезнь не вызывает.
е) Симптомы на травянистых хозяевах. Описание симптомов, вызываемых вирусом короткоузлия, на отдельных видах травянистых хозяев следует искать в оригинальных работах. Они настолько изменчивы, что здесь их суммировать трудно, так как в разных странах они различаются в зависимости от штаммов вируса, вида тест-растения и условий окружающей среды. Здесь суммированы результаты работ автора с французскими изолятами вируса короткоузлия.

Рис. 110. Слева вверху - посветление жилок на новых листьях Chenopodium quinoa, появившееся через 10 дней после механической инокуляции вирусом короткоузлия. Слева в середине - тот же вид через 25 дней после инокуляции; интенсивность проявления симптомов различается в зависимости от отдельных штаммов вируса: 'нормальный' штамм, допускающий почти полное выздоровление растений (слева); 'сильный' штамм F13, вызывающий устойчивую мозаику и деформацию листьев (справа). Слева внизу - системные симптомы Chenopodium amaranticotor через 15 дней после инокуляции. Справа вверху - Gomphrena globosa, сорт Пурпур Тезье, с локальными поражениями на инокулированных листьях. Справа внизу - тот же вид: листья скручены в результате системного заражения
Chenopodium quinoa. Местные поражения на инокулированных листьях заметны только при использовании некоторых вирулентных изолятов [331]. Большинство штаммов не вызывает местных поражений, которые можно было бы использовать для количественных исследований. Системные симптомы выражаются в посветлении жилок на молодых листьях, образовавшихся через 8 или 10 дней после инокуляции (рис. 110, вверху слева); через 15 - 20 дней симптомы постепенно ослабевают и совершенно исчезают, кроме тех случаев, когда в опытах используются более сильные штаммы, вызывающие стойкую деформацию листьев [331]. В летнее время симптомы быстро маскируются, и в конце осени посветление жилок уже не наблюдается, а отмечаются только эпинастия молодых листьев и "белая" окраска верхушек (рис. 110, средний слева).
Chenopodium amaranticolor реагирует таким же образом, но более медленно, чем С. quinoa (рис. 110, внизу слева). Для развития системной мозаики требуется 15 - 17 дней.
Gomphrena globosa. На инокулированных листьях сорта Пурпур Тезье иногда возникают темно-лиловые пятна неправильной формы (рис. 110, вверху справа). Затем, когда растения становятся системно зараженными, на небольшом числе листьев появляются мозаика и скручивание (рис. 110, внизу справа), но с точки зрения выраженности симптомов этот вид является плохим индикатором вируса короткоузлия, за исключением его вирулентных штаммов. Главным достоинством данного тест-растения является его способность дифференцировать вирус корот-коузлия от вируса мозаики резухи (типичные штаммы вируса мозаики резухи из Великобритании вызывают местные поражения на инокулированных листьях, но не системную инфекцию). Таким образом, этот хозяин позволяет резделить короткоузлие (системное заражение) от мозаики резухи (только местные поражения). Другое дифференцирующее растение Tetragonia expansa (новозеландский шпинат) также отделяет мозаику резухи (системная инфекция) от короткоузлия (невосприимчивость). Однако последние исследования, проведенные на "промежуточных" изолятах вируса из винограда, серологически очень близких к вирусу мозаики резухи, но практически неотличимых от вируса короткоузлия по кругу травянистых хозяев и симптомам [328], вероятно, уничтожат всякие шансы на дифференциацию двух явно различных серотипов: мозаики резухи и короткоузлия винограда на основании реакций указанных тест-растений.
Cucumis sativus, сорт Корнишон Зеленый Парижский. Некоторые изоляты вируса короткоузлия вызывают светло-зеленые местные поражения на инокулированных семядолях (рис. 111, вверху слева). Затем через 15 - 20 дней различное число растений становится системно зараженными и на них появляется мозаика с многочисленными светло-зелеными пятнами, а иногда сильно деформированные листья (рис. 111, вверху справа).
Phaseolus vulgar is, сорта Процессор или Принц. Местные поражения на инокулированных первых листьях отсутствуют или появляются очень редко (в зимних условиях). Системные симптомы кольцевой пятнистости или мозаики развиваются на некоторых тройчатых листьях через 15 - 30 дней (рис. 111, внизу).
Виды Nicotiana (табак). С точки зрения симптоматологии эти хозяева мало пригодны для вируса короткоузлия. Вирус можно было выделить из инокулированных листьев, но заразить системно удалось только N. clevelandii. В наших исследованиях мы никогда не наблюдали на растениях Nicotiana кольцевые и линейные узоры, о которых упоминают некоторые исследователи.

Рис. 111. Вверху слева - сеянцы огурца (сорт Корнишон Зеленый Парижский): видны местные поражения на инокулированных семядолях. Вверху справа - симптомы системного поражения плети того же сорта. Внизу - молодые тройчатые листья фасоли сорта Процессор, пораженные кольцевой пятнистостью (слева) и мозаикой (справа)
Комплексные инфекции. а) В растениях винограда. В растениях винограда могут присутствовать одновременно различные вирусы, но не доказано формирование "комплексных инфекций" в смысле изменения симптоматологии или синергизма. Нередко вирусы короткоузлия и скручивания листьев заражают одно и то же растение, оказывая аддитивный эффект в отношении симптомов, роста и урожая. И даже экспериментально доказано, что одно и то же растение винограда может нести в себе различные штаммы вируса короткоузлия: 1) среди вегетативного потомства растений, зараженных короткоузлием, попадаются иногда экземпляры, пораженные желтой мозаикой, или, наоборот, материнские растения, зараженные желтой мозаикой, дают некоторое число растений, пораженных только "зеленым короткоузлием"; 2) растения, зараженные короткоузлием, кроме того, можно заразить желтой мозаикой с помощью прививки или естественным путем через почву [97, 317].
Недавно было доказано, что некоторые вирусы кольцевой пятнистости, например черной кольцевой пятнистости томатов в ФРГ "19], так же как и мозаики резухи в ФРГ и, возможно, во Франции 331], могут иногда объединяться с короткоузлием, но еще не установлено, присутствуют ли эти вирусы как случайные латентные загрязнители или же играют какую-либо роль в болезни, наблюдаемой у зараженных растений. Необходимо также выяснить точно долю участия вируса короткоузлия в появлении на листьях особых симптомов, носящих в некоторых странах такие названия, как листовидные выросты на нижней поверхности листьев (enation) в Италии и ФРГ [132, 148] и legno riccio или "ямчатость штамба" и "некроз побегов" в Италии [148, 197].
В Венгрии из некоторых кустов с симптомами желтой мозаики и короткоузлия недавно выделили вирус, не связанный с короткоузлием [194]. Для выяснения вопроса о том, широко ли распространен этот новый вирус в Венгрии или он является только случайным загрязнителем кустов, уже зараженных короткоузлием, требуются дальнейшие исследования.
б) В травянистых хозяевах. Симптомы иногда изменяются в течение ряда последовательных передач путем механической инокуляции изолятов вируса короткоузлия травянистым хозяевам. Этот факт соответствует гипотезе о смешанных заражениях одного и того же растения более чем одним вирусом. Однако в растениях Chenopodium amaranticolor [101] и С. quinoa [329, 331] было совершенно ясно показано существование перекрестного иммунитета между штаммами вируса короткоузлия. При системном заражении определенным штаммом вируса короткоузлия эти растения становятся уже невосприимчивыми к механической субинокуляции другим, более вирулентным штаммом того же вируса. Однако они сохраняют восприимчивость к контрольной инокуляции другими, неродственными вирусами кольцевой пятнистости (черной кольцевой пятнистости томата, кольцевой пятнистости малины и кольцевой пятнистости томата) и даже к вирусу мозаики резухи, который близок к вирусу короткоузлия. В этом случае инкубационный период длится немного дольше, чем обычно [101].
Возбудитель. Свойства, присущие инфекционному вырождению винограда, приводят к сравнению его возбудителя с передающимися через почву вирусами кольцевой пятнистости, поражающими персик, вишню и малину [313]. И, действительно, было обнаружено, что кусты винограда, зараженные короткоузлием и желтой мозаикой, содержат такой вирус кольцевой пятнистости, выделенный впервые Кадменом и др. [54] путем механической инокуляции травянистых растений-хозяев. Многие исследователи выделяли тот же вирус из виноградных кустов, пораженных короткоузлием или желтой мозаикой в большинстве стран мира. Было показано, что вирус содержится в экстрактах из виноградных лоз [321, 330] и его можно передать обратно винограду, вызвав у него симптомы короткоузлия и желтой мозаики [102, 192, 276]. Несомненно, что выделенный вирус кольцевой пятнистости является возбудителем болезни.
Свойства вируса короткоузлия были определены сначала в соке травянистых растений, а затем в экстрактах тканей винограда.
а) Предельное разведение. Опубликованные данные сильно различаются между собой и колеблются от 1 :500 до 1 : 50000 [192]. Такие колебания можно проследить вплоть до различий в скорости размножения отдельных штаммов из разных стран. По определениям автора, для французских штаммов вируса короткоузлия предельное разведение сока Chenopodium quinoa составляло от 1 : 1000 до 1 :2000.
б) Температура инактивации. Температура, при которой сок через 10 мин. теряет инфекционность, также сильно варьирует для отдельных штаммов вируса короткоузлия и колеблется от 55 - 56 до 62 - 64°С [192]. Наши определения показали, что для французских штаммов в соке С. quinoa температура инактивации составила 55 - 56°С [321, 322]; эта температура наиболее близка к данным Брюкбауэра и Рюделя [48 - 50].
в) Долговечность in vitro. Инфекционность сохраняется в пределах от нескольких недель при 18 - 20°С до нескольких месяцев в замороженном состоянии при -20°С. По нашим определениям, при 4°С она сохранялась в забуференном соке С. quinoa 34 дня, но не в течение 64 дней, и в экстрактах из листьев винограда, содержащих никотин,- свыше 4 дней [321]. При -15°Сминфек-ционность можно сохранять в течение нескольких месяцев не только в экстрактах С. quinoa, но и в экстрактах из листьев винограда, содержащих никотин [321]. Однако замораживание образцов может вызвать снижение инфекционности и некоторые качественные изменения симптоматологии штаммов. Антигенность замороженных образцов может сохраняться значительно дольше, чем инфекционность (в течение года и дольше) [328].
г) Очистка. Вирус короткоузлия можно осадить из инфекционного сока с помощью химикатов [98 - 100], например 30%-ным насыщенным сульфатом аммония, 30 - 40%-ным ацетоном или этанолом, предпочтительно вблизи изоэлектрической точки вируса (рН5). Согласно нашим данным, при подобных методах очистки теряется большое количество вируса. Для очистки вируса короткоузлия, выделенного из травянистых хозяев, чаще всего применяются различные модификации метода Стара, разработанного для вируса кольцевой пятнистости табака (эмульгирование сока в смеси бутанола с хлороформом и несколько циклов центрифугирования при высоком и малом числе оборотов) [101]. Но сохраняющиеся нуклео-протеины хозяина, загрязняющие вирус, можно удалить только центрифугированием в градиенте плотности сахарозы [192] или электрофорезом [291].
Иммунные сыворотки к вирусу короткоузлия можно использовать также в качестве специфических агентов преципитации вируса из сока травянистого хозяина, а также из экстрактов растений винограда [330]. При исследовании преципитатов антиген-антитело под электронным микроскопом видно, что они образуются из агрегированных вирусных частиц. Преципитаты, содержащие вирус короткоузлия, очень легко изолировать в агаровом геле [326] по методу Аллена и Тремена [3], разработанному для выделения вируса некротической кольцевой пятнистости Prunus.
д) Форма и величина вируса. Очищенные препараты, отличающиеся высокой инфекционностью, содержат многочисленные полиэдрические частицы, сходные с частицами других вирусов, вызывающих кольцевую пятнистость. В напыленных препаратах их диаметр равен 25 - 30 ммк [54, 192], а в фосфорно-вольфрамовых - 22 ммк [322]. Подобные частицы обнаружены не только в травянистых хозяевах, но и в экстрактах из виноградных листьев, в которых вирус короткоузлия был осажден приготовленной к нему иммунной сывороткой [330].
е) Серология. Инъекция кроликам концентрированных препаратов вируса короткоузлия вызывает образование специфических антител. Титр иммунных сывороток обычно достигает 1 : 512 - 1 : 1028 при испытании против штаммов вируса короткоузлия. При использовании метода иммунодиффузии в геле все штаммы вируса короткоузлия реагировали с антисыворотками к вирусу короткоузлия без каких-либо признаков "перекреста" или образования "шпоры". Следовательно, все они были очень близки между собой. Некоторые антисыворотки к вирусу короткоузлия в разведениях до 1:16 или даже 1 : 64 реагируют также с вирусом мозаики резухи, и, наоборот, антисыворотки к вирусу мозаики резухи в разведении до 1 : 64 - 1 : 125 реагируют с некоторыми изолятами, выделенными из больных растений винограда.
Эти результаты требуют обсуждения, поскольку такие перекрестные реакции не всегда удается легко получать [19, 331], даже используя неразведенную антисыворотку с высоким титром и варьируя разведения антигена, чтобы избежать возможной маскировки реакции в результате "зонального феномена" [203].
Выделение из больных кустов винограда вирусов мозаики резухи и короткоузлия [19] может подтверждать мысль о том, что полученные в прошлом некоторые изоляты фактически представляли собой смеси вирусов короткоузлия и мозаики резухи. Однако было бы наивно заключать на этом основании, что наблюдавшиеся перекрестные реакции в каждом случае вызывались смешанными изолятами обоих вирусов. В действительности вирусам короткоузлия и мозаики резухи свойственна частичная идентичность перекрестно-серологических взаимосвязей, которая становится заметной при проведении иммунодиффузионных тестов по Охтерлони [211]. Линии преципитации, соответствующие вирусам короткоузлия и мозаики резухи, образуют шпоры, но никогда не дают перекрестов, которые наблюдаются при использовании смесей неродственных вирусов. Однако соответственные количества общих антигенных детерминантов обоих вирусов, вероятно, могут варьировать от высоких до низких и практически до полного отсутствия в зависимости от отдельных штаммов вирусов короткоузлия и мозаики резухи. Подобная гипотеза может объяснить большую часть приводимых в литературе наблюдений, которые противоречат предшествующему выводу: вирусы мозаики резухи и короткоузлия винограда различаются по многим биологическим свойствам, но относятся к одному и тому же серотипу [101].
Дифференциальный диагноз короткоузлия в случае смешанной инфекции с вирусом мозаики резухи возможен с помощью серологии при использовании умеренно разведенной (примерно 1 : 50) антисыворотки, когда количество гетерологичных антител становится крайне незначительным.
При помощи серологии можно также обнаружить бессимптомные зараженные растения среди инокулированных травянистых хозяев или виноградных лоз, отобранных для размножения. В ряде случаев для серологических тестов можно использовать осветленный сок соответствующих хозяев, например Nicotiana clevelandii [101]. Однако более часто концентрация вируса слишком низкая и не вызывает заметных реакций преципитации, если только антиген не концентрируют искусственными методами. При работе с виноградом обычно отбирают для каждого образца по 10 молодых листьев, предпочтительно весной (когда концентрация вируса короткоузлия достигает максимума), и гомогенизируют их в 40 мл воды (или фосфатного буфера), содержащих 2,5% никотина. После осветления экстракты ультрацентрифугируют (Спинко Ротор 30) в течение 2,5 ч при 105000 X g. Надосадочную жидкость отбрасывают, а осадки, содержащие все присутствующие вирусы, повторно суспендируют в 1 мл воды. Такие экстракты очень грубы, но их вполне можно испытывать по Охтерлони серологическим методом диффузионной преципитации в геле: обычно реакции каждого отдельного образца с целой шкалой разведений антисыворотки к вирусу короткоузлия испытываются в сравнении с контрольным экстрактом, содержащим частично очищенный вирус короткоузлия [211].
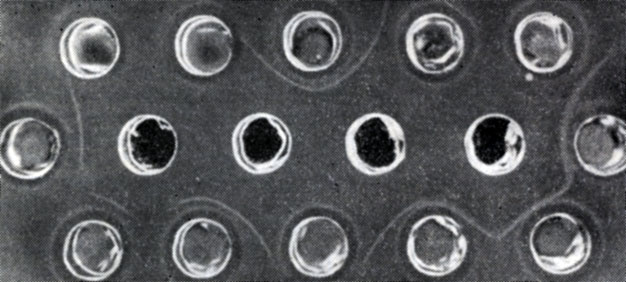
Рис. 112. Серологическая реакция иммунодиффузии в геле по Охтерлони между сывороткой, иммунной к короткоузлию (центральные лунки), и концентрированными экстрактами листьев винограда (периферические лунки). Специфические линии преципитации окружают лунки, содержащие вирус короткоузлия
Характерная линия преципитации образуется в зоне, где антигены и антитела встречаются в оптимальных соотношениях, и вполне совпадает с линией, соответствующей лункам, заполненным частично очищенным вирусом (контроль). Таким образом, исключается возможность путаницы с линиями, не специфичными для вируса, но соответствующими белкам растения-хозяина (рис. 112).
Передача зараженной древесиной. Короткоузлие легко передается при вегетативном размножении зараженных растений (через черенки, подвои или привои). Кроме того, если здоровые привои прививают на зараженные подвои или наоборот, то через несколько месяцев после срастания все растение оказывается зараженным вирусом. Такой зараженный материал вносит короткоузлие в новые виноградники. Следовательно, главным фактором распространения болезни является человек.
Передача прививкой применяется для диагноза болезни путем индексирования на соответствующих индикаторных сортах винограда.
Передача механической инокуляцией. а) От винограда винограду. В природе механическая инокуляция вируса короткоузлия вряд ли происходит; в литературе описан единственный случай передачи мозаики "melnik" (возможно, родственной короткоузлию) в северной Чехословакии [271, 272].
б) От винограда травянистому хозяину. Для механической передачи вируса короткоузлия от винограда травянистому хозяину Кадмен и др. [54] использовали никотин. Это вещество, которое Корнюэ и др. [84] впервые использовали в работе с вирусами георгины, по-прежнему остается очень ценным средством сохранения вируса в соке растений, содержащих танины. В отношении вируса короткоузлия также применялись фосфатный буфер, углекислый натрий и окись алюминия, но с меньшим успехом, чем никотин.
в) От травянистого хозяина травянистому хозяину. Вирус короткоузлия можно обычно очень легко передать механически, но если его нужно передать целому ряду различных видов хозяев, то инокулюм необходимо применять в умеренном разведении, чтобы ослабить активность ингибиторов. Промежуточным хозяином, пригодным для приготовления инокулюмов, считается Gomphrena globosa, содержащая минимум ингибиторов [98].
г) От тест-растений винограду. Известно несколько случаев, когда в результате простого контакта тканей без срастания прививок вирус короткоузлия передавался от Chenopodium amaranticolor винограду [100]. В других опытах Хьюитт и Кори [162], Мартелли и Хьюитт [192], Тейлор и Хьюитт [276] передавали вирус винограду путем механической инокуляции. Сначала выращивали этиолированные сеянцы или черенки сортов Мисьон (Vitis uinifera) .или Сент-Джордж (V. rapestris} для этого их содержали в темных помещениях, ежечасно освещая в течение только 3 мин. Для инокуляции листья предварительно опыливали корундом, а затем натирали суспензией очищенного вируса короткоузлия, выделенного из травянистых растений-хозяев. Через три или четыре недели на инокулированных листьях появлялись маслянистые пятна, а позднее на вновь развивающихся листьях - системная мозаика; некоторые растения погибли (некроз верхушек). Из инокулированных растений винограда был снова выделен вирус короткоузлия.
Передача через живых переносчиков. Как и другие вирусы, вызывающие кольцевую пятнистость, вирус короткоузлия винограда не передается через насекомых. Попытки передать его через тлю Муzus persicae (Sulz.) травянистым растениям [100] и через Phylloxera radicicola - винограду [170, 210, 311] оказались безуспешными. В природных условиях инсектициды, внесенные в почву, зараженную короткоузлием, не оказывали влияния на инфекционность.
Только фумиганты-нематоциды воздействуют на передачу вируса короткоузлия [311 - 313, 315, 318]. Опыты Хьюитта и др. [170] впервые показали, что переносчиками вируса короткоузлия являются обитающие в почве нематоды. Нематода Xiphinema index считается единственным естественным переносчиком короткоузлия. Раньше предполагалось, что такую же роль играет Criconemoides хеnорlax, но для Калифорнии это не подтвердилось. По-видимому, в Европе существует такое же положение: только в опытах с X. index были получены положительные результаты [260, 329].
Ниже описывается методика опытов по передаче вирусов нематодами.
В сосуды со стерилизованной почвой, содержащие по одному здоровому и одному больному растению, служащему источником вируса, вносят специально отобранных нематод подозреваемого вида; в другие сосуды (контроль) нематод не вносят; вирус передается лишь в том случае, если вносимый вид является переносчиком. Другие опыты можно проводить в сосудах, содержащих только здоровые растения, куда помещают специально отобранных нематод, питавшихся предварительно на корнях больных виноградных лоз. Процент передачи можно определить, подсчитав зараженные растения. Однако до начала появления симптомов заболевания на листьях зараженных кустов может пройти несколько лет. Более быстрый метод заключается в выделении вируса путем механической инокуляции травянистых тест-растений (Chenopodium quinoa) экстрактами из кончиков корешков, на которых питались инфекционные Xiphinema index [274, 329]. По данным американских исследователей, вирус короткоузлия можно выделить даже путем механической инокуляции травянистых хозяев небольшими кусочками нематод, разрезанных в капле воды. С помощью таких опытов было установлено, что X. index может воспринять вирус короткоузлия за один день или за меньший срок; вирус сохраняется в них не меньше 90 дней, если нематоды голодают, и всего 7 дней, если они питаются на растениях, невосприимчивых к вирусу. Вирус могут передавать взрослые нематоды и личинки всех возрастов. Однако личинки, питавшиеся на зараженных растениях, после линьки становятся неинфекционными. Молодые личинки, отродившиеся из яиц, отложенных самками, питавшимися на зараженных растениях, не инфекционны (трансовариально инфекция не передается) [229, 230, 274J.
Распространение в естественных условиях. В некоторых странах единственным переносчиком вируса короткоузлия является человек. В этом случае пораженные растения беспорядочно распространяются в результате посадок и прививок.
Во многих зонах виноградарства характер распространения зараженных растений в старых виноградниках бывает совершенно иным, и это показывает, что короткоузлие и желтая мозаика распространяются по типу эпифитотий. Пораженные растения образуют регулярные группы, занимающие один или несколько участков более или менее круглой формы. Число пораженных растений год от года увеличивается. Изучение распространения короткоузлия в природе дало следующие результаты: а) характер распространения исключает возможность передачи болезни любым надземным (летающим) переносчиком; б) безрезультатность обработки почвы высокими дюзами инсектицидов или фунгицидов исключает возможность того, что переносчиком являются почвообитающие насекомые [312]; в) инфекционность почвы исчезает после обработки ее высокими дозами таких фумигантов, как препарат ДД (дихлорпропен-дихлорпропан), бромистый метил, дибромэтилен, хлорпикрин* и сероуглерод** [311, 312, 318].
*(В СССР применение хлорпикрина для почвенной фумигации разрешено с ограничениями. - Ред.)
**(В СССР не применяется. - Ред.)
В вегетационных сосудах и полевых опытах постоянно отмечалась корреляция между присутствием Xiphinema index в почве и зараженностью приманочных растений короткоузлием [4, 181, 260, 329]. Но пытаться предсказывать возможность распространения короткоузлия на основании численности X. index в пробах полевой почвы безусловно рискованно, особенно в северных виноградниках, расположенных в зоне суровых зимних морозов, которые сильно снижают численность популяций нематод.
Меры борьбы. а) В более старых зараженных виноградниках. Обильное удобрение почвы повышает мощность пораженных кустов и в течение некоторого времени поддерживает их продуктивность на приемлемом уровне. Поскольку при повреждениях корневой системы и сильной обрезке симптомы усиливаются, следует избегать глубокой культивации почвы и применять более слабую обрезку.
б) В новых виноградниках. Для закладки новых виноградников требуется посадочный материал, свободный от вирусов; рекомендуется использовать сертифицированные растения. Очень важные и специальные меры борьбы с короткоузлием должны предусматривать возможную зараженность почвы. Для полного очищения почвы от вируса рекомендуется держать почву под паром в течение 10 лет, но и более короткие периоды парования обеспечивают заметное снижение зараженности. Всюду, где длительное парование неприменимо по экономическим причинам, особенно в наиболее ценных районах виноградарства, после выкорчевки старых зараженных виноградников необходимо провести фумигацию почвы перед новыми посадками.
Внесение препарата ДД из расчета 1120 кг/га или эквивалентной дозы других нематоцидов обычно достаточно надежно предупреждают повторные заражения короткоузлием и обеспечивают значительное повышение урожаев новых плантаций. Однако для получения таких результатов на глубоких почвах требуется применять очень высокие дозы фумигантов.
Терапия. Обработка древесины, находящейся в покое (черенки, прививочная древесина), горячей водой (55°С) в течение 5 мин не освобождает растения винограда от вируса короткоузлия. Однако вегетирующие растения реагируют на тепловую терапию. Бови [34] первый применил в отношении лоз, зараженных короткоузлием, воздействие температурой 37 - 38°С в течение нескольких недель. Удалить вирус ему не удалось, но симптомы были на некоторое время ослаблены. Усовершенствование термических методов лечения винограда, достигнутое в Америке и Европе на лозах, выращенных в сосудах или на искусственных питательных средах in vitro, обусловило высокий процент освобождения обработанных лоз от вируса короткоузлия, а иногда и полное их освобождение от него [122 - 125, 134, 138].
Обнаружение и идентификация. Обычно можно очень легко отличить короткоузлие от различных нарушений и расстройств, обусловленных генетическими факторами [104, 105], климатическими или почвенными условиями (например, поздними весенними заморозками), недостатком бора или цинка [77] и повреждением гербицидами, вызывающими деформацию листьев (2,4-Д) или пожелтение жилок (монурон-диурон). Но для окончательного диагноза требуется проведение указанных ниже опытов по передаче вируса: индексирование прививкой на лозу индикаторных сортов (особенно Vitis rupestris); анатомическое исследование для обнаружения трабекул у соответствующих сортов винограда (Кобер 5ВВ; Телец-кий 5С); механическая инокуляция травянистых хозяев. Симптомы, появляющиеся на Chenopodium quinoa, С. amaranticolor и Gomphrenа globosa, обычно помогают отличить короткоузлие от других вирусов, вызывающих симптомы кольцевой пятнистости и поражающих виноградные лозы. Серологические тесты с использованием экстрактов виноградных лоз или травянистых растений и соответствующих разведений иммунных сывороток к вирусам, вызывающим кольцевую пятнистость, а именно: черной кольцевой пятнистости томата, кольцевой пятнистости томата, мозаики резухи и короткоузлия винограда.
ЖЕЛТАЯ МОЗАИКА (GRAPEVINE YELLOW MOSAIC)
Синонимы. Clorose infecciosa; giallume infettivo; mosaika; panachure; Panaschure.
История и географическое распространение. Желтая мозаика широко распространена в Европе и Северной Америке (Калифорния); она встречается также в Северной Африке, Южной Америке (Аргентина) и Австралии. По-видимому, болезнь имеет европейское происхождение, и ее распространение совпадает с широким использованием филлоксероустойчивых подвоев [79]. Болезнь была описана во Франции в 1914 г.; позднее было доказано, что она передается прививкой [41]. Желтая мозаика часто встречается на лозах, пораженных короткоузлием или окаймлением жилок, и является компонентом инфекционного вырождения - комплекса вирусных болезней винограда, передающихся через почву.

Рис. 113. Вверху - хромово-желтые участки на листе сеянца сорта Витал (Vitis vinifera) после передачи ему вируса прививкой. Внизу - лист того же сорта, пораженный желтой мозаичной крапчатостью
Экономическое значение. Лозы постепенно вырождаются; их мощность и урожаи уменьшаются. Поражение некоторых культурных сортов приводит к полному бесплодию и позднее к гибели лоз. Из Чехословакии имеются сообщения о полном уничтожении некоторых сортов.
Круг растений-хозяев. Желтая мозаика поражает только род Vitis; естественными хозяевами являются культурные сорта V. vinifera. К искусственной инокуляции прививкой восприимчивы V. aestivalis Michx., V. amurensis Rupr., V. baileyana Munson, V. ber-landieri Planch., V. coignetioe Pulliat, V. labrusca L., I7, palmata Vahl., V. riparia Michx., V. rupestris Scheele, а также различные гибриды, часть которых используется главным образом в качестве подвоев.
Вирус можно передать механически от зараженных виноградных лоз растениям Chenopodium amaranticolor, С. quinoa и Gomphrena globosa и последовательно широкому кругу травянистых растений, включающему 32 вида и 5 сортов.
Симптомы. Болезнь характеризуется хромово-желтой крапчатостью листьев в начале весны. Побеги могут частично или полностью пожелтеть. К листовым симптомам относятся пожелтение сетки жилок, желтое окаймление жилок, желтые пятна и сплошное пожелтение (рис. ИЗ). По мере старения листьев хромово-желтая крапчатость бледнеет, иногда принимает кремовую окраску. Кремовые участки могут побелеть и в более поздний период лета некроти-зироваться. В конце концов эти омертвевшие листья опадают. В конце весны и летом симптомы могут появиться на новых листьях. Грозди мельчают и содержат много мелких дробевидных ягод.
Листья обычно сохраняют свои нормальные контуры, но у некоторых сортов деформируются, и на растениях появляются побеги с двойными узлами или укороченными междоузлиями. В ксилеме и флоэме побегов на пораженных кустах образуются трабекулы.
Промышленные сорта, подвои и другие виды Vitis реагируют на заражение появлением характерной хромово-желтой окраски. Форма и интенсивность проявления этого симптома варьируют в зависимости от сезона, вида, сорта и вирулентности штамма вируса. Однако на сортах Зейбель 10790, Сейн-Виллар 5-247, Vitis betulifolia, V. mexicana и V. sinensis (piasezkii) этот симптом, по-видимому, не развивается [309, 310]. Имеются сообщения, что на листьях сорта Сент-Джордж (V. rupestris) вирус вызывает (наряду с характерной хромово-желтой крапчатостью) линейный узор, а позднее сетчатость.
На растениях Chenopodium amaranticolor, С. quinoa и Gomphrena globosa симптомы варьируют в зависимости от штамма вируса и условий окружающей среды. На инокулированных листьях этих хозяев могут появиться или отсутствовать слабые хлоротичные поражения. К числу системных симптомов у видов Chenopodium относятся временное пожелтение сетки жилок, посветление жилок, хлоротичное окаймление жилок и мозаичная крапчатость. Некоторые вирулентные штаммы вызывают деформацию листьев. У G. globosa скручивание верхушечных листьев сопровождается появлением хлоротичной пятнистости, крапчатости и дальнейшей деформацией листьев по мере их развития.
Возбудитель. Желтую мозаику вызывает передающийся через почву вирус из группы НЕПО-вирусов [53]. Его физические свойства различаются в зависимости от штамма. Большинство штаммов инактивируется при нагревании в течение 10 мин при 58 - 62°С. Предельное разведение колеблется от 1 : 500 до 1 : 20 000; устойчивость к выстаиванию - от 1 до 2 недель. Вирусные частицы имеют сферическую форму (вероятно, являются икосаэдрами); диаметр их равен примерно 28 - 30 ммк. Считают, что вирусы желтой мозаики и короткоузлия серологически очень близки. Хотя оба они имеют небольшое число антигенных компонентов, общих с вирусом мозаики резухи, но предполагается, что оба они лишь отдаленно родственны последнему. Вирус желтой мозаики защищает виды Chenopodium и Gomphrena globosa от заражения штаммами вируса короткоузлия [101].
Результаты других опытов показывают, что изоляты этих вирусов оказывают только частичную защиту друг от друга [276]. От заражения вирусом мозаики резухи эти вирусы не защищают.
При реципрокных инокуляциях вирусами желтой мозаики и короткоузлия с помощью прививки на виноград не наблюдалось никакого защитного действия.
Передача. Искусственную передачу можно осуществлять различными способами прививки; окулировка в приклад обеспечивает получение наиболее быстрых и стойких результатов [166]. Продолжительность инкубационного периода в виноградных лозах колеблется от 7 недель до 12 месяцев и более.
Вирус передается травянистым растениям из зараженных листьев и кончиков корешков, мацерированных в фосфатном буфере при рН 7 - 8 или в 2,5%-ном растворе никотина. Передача осуществляется быстрее весной и осенью, а также в тех случаях, когда в качестве источника инокулюма используют более молодые листья. Выдерживание перед инокуляцией в течение 24 - 48 ч в темноте (этиолирование) повышает восприимчивость травянистых хозяев к заражению. Системные симптомы появляются через 7 - 20 дней.
По имеющимся данным, вирус был передан искусственно зараженным растениям Chenopodium amaranticolor через семена. Повилика не передавала вирус ни этому виду, ни от него. Передача через пыльцу не отмечена.
Нематода Xiphinema index передает вирус желтой мозаики. Переносчиками являются как взрослые, так и личиночные формы. На кустах винограда, растущих на почвах, содержащих инфекционных нематод, симптомы появляются через год. Переносчик воспринимает вирус от одних сортов быстрее, чем от других. Взаимосвязь переносчика с вирусом не установлена, но она, вероятно, аналогична связи между X. index и вирусом короткоузлия.
Распространение в естественных условиях. Болезнь встречается на отдельных участках и распространяется с краев этих зараженных участков со скоростью примерно 60 - 90 см в год. Зараженные корни, остающиеся в почве, действуют как единственные резерваты вируса и служат основными хозяевами, на которых продолжают существовать переносчики. Сорняки, произрастающие на зараженных участках, обычно никакой роли в распространении вируса желтой мозаики не играют, поскольку не являются естественными хозяевами ни переносчика, ни вируса.
Xiphinema index встречается в виноградниках Европы (в зоне Средиземноморья), в Аргентине и Калифорнии. На ее географическое распространение влияют, по-видимому, климатические факторы. Нематода не переносит продолжительного замораживания; этим может объясняться отсутствие ее в почвах виноградников в провинции Онтарио (Канада).
Многочисленные популяции переносчика появляются в почвах насаждений инжира в Средиземноморье, и высаженные там зараженные лозы могут распространить болезнь.
Меры борьбы. Практическая борьба зависит от использования посадочного материала, свободного от вируса, и отсутствия нематоды-переносчика. Очень трудно уничтожить переносчика и обезвредить в почве остатки зараженных корней. Нематоды обитают в почве и на корнях на глубине 2 - 3 м. Фумиганты вряд ли могут полностью проникнуть на такую глубину. По имеющимся сообщениям, препарат ДД и бромистый метил уничтожали X. index в почвах, зараженных желтой мозаикой и короткоузлием, на глубине 1,4 м. Высаженные затем на этих участках кусты винограда оставались здоровыми [319]. В Калифорнии эти результаты не подтвердились [166].
Терапия. Свободные от вируса лозы были получены от растений, подвергавшихся в течение 4-5 недель воздействию 38°С, после чего верхушки побегов срезались и окоренялись в вермикулите или на питательном агаре. Здоровые растения удавалось также получать, выращивая верхушечные побеги с зараженных растений в течение 3 месяцев на питательном агаре при 33°С.
Примечания. Считается, что желтую мозаику, короткоузлие и окаймление жилок вызывают штаммы одного и того же вируса. Хотя на винограде все они вызывают ясно отличающиеся симптомы, на травянистых хозяевах эти штаммы неразличимы.
Вопрос о том, в какой мере вирус желтой мозаики существует в природе как самостоятельный агент, требует дальнейшего изучения. На кустах, зараженных желтой мозаикой и окаймлением жилок, часто появляются некоторые симптомы короткоузлия. Кроме того, Xiphinema index воспринимает и раздельно передает вирусы короткоузлия и желтой мозаики с растений, на которых заметны симптомы только желтой мозаики.
Обнаружение и идентификация. Вирус желтой мозаики вызывает диагностические симптомы хромового пожелтения на сортах Сент-Джордж (V. rupestris), Мисьон, Кариньян, Бессемянный Томпсона, Витал и Фернао Пирес (V. vinifera) и на гибриде Кобер 5ВВ (V. berlandieri'XV. riparia). Вирус можно обнаружить путем механической инокуляции Chenopodium amaranticolor и С. qainoa, но в смешанных инфекциях ни один хозяин не дифференцирует его от других так называемых штаммов (вирусов короткоузлия и окаймления жилок).
ОКАЙМЛЕНИЕ ЖИЛОК VITIS (VEIN BANDING OF VITIS)
Синонимы и взаимосвязи. Scolorazione perinervale [188]. Окаймление жилок вызывает один из группы вирусов Vitis, передающихся через почву. Эту группу составляет ряд штаммов, серологически очень близких друг к другу и несколько более далеких от вируса мозаики резухи. В Европе синдром болезни, вызываемый вирусами, передающимися через почву, обозначают термином "инфекционное вырождение" (degenerescence infectieuse).
История и географическое распространение. Вместе с посадочным материалом окаймление жилок распространилось из Европы в большинство районов виноградарства всего мира. Оно редко встречается в Южной Африке (П. Энгельман, личное сообщение), а также в Южной Австралии [116]. Редкая встречаемость вирусов, передающихся через почву, в Южной Австралии, куда импорт виноградных лоз был запрещен в 1894 г., косвенным образом доказывает, что до организации питомников для прививок винограда на филлоксероустойчивые подвои эти вирусы не имели широкого распространения в Европе.
Экономическое значение. Все исследователи упоминают о плохом завязывании плодов на лозах, пораженных окаймлением жилок. Вудхем и Александер [345] сообщали, что клоны сорта Султана (Бессемянный Томпсона), несущие симптомы окаймления жилок, давали урожай на 50% ниже, чем клоны, на которых симптомы отсутствовали.
Круг растений-хозяев. Болезнь широко распространена в пределах рода Vitis. Она поражает V. vinifera, V. rupestris, V. riparia, V. berlandieri, V. solonis (longii), V. champinii, V. labrusca и их гибриды.
Вирус окаймления жилок был экспериментально передан механической инокуляцией от Vitis растениям Chenopodium amaranticolor, С. quinoa, С. murale, С. foetidum, С. album, Gomphrena globosa, Cucumis sativus, Nicotiana clevelandii, Phaseolus vulgaris.
Симптомы. Симптомы окаймления жилок редко образуются до конца весны или начала лета; к этому времени вдоль главных жилок на взрослых листьях появляются ясно выраженные хромово-желтые участки (рис. 114, вверху слева). Симптомы могут остаться локализованными или постепенно распространиться на мелкие жилки (рис. 114, внизу слева). На небольшом числе листьев пожелтение бывает связано только с мелкими жилками. Этот симптом не так ясно выражен, как более типичное пожелтение вдоль крупных жилок. У некоторых сортов симптомы образуются на большинстве листьев к середине лета; у других даже к концу лета или осенью бывают поражены только немногие листья. Листья пораженных лоз могут быть асимметричны, но в остальном нормальны.
В период цветения многие цветки опадают с кистей, а затем на гроздьях наряду с нормальными плодами развиваются мелкие бессемянные ягоды, придающие гроздьям беспорядочный вид (рис. 114, справа). В некоторые годы симптомы на плодах и листьях бывают выражены сильнее, чем в другие. Хотя зараженные кусты винограда не проявляют задержки роста, однако в общем они развиты слабее, чем здоровые.
На сортах подвоев обычно отсутствует ясно выраженное хлоро-тичное окаймление жилок. Такие симптомы, как линейный узор и посветление жилок, всего яснее выражены у сорта Сент-Джордж. На сорте Кобер 5ВВ на отдельных участках листьев появляется крапчатость или диффузный линейный узор, иногда наряду со слабым окаймлением жилок.
На своих травянистых хозяевах вирус окаймления жилок примерно через 10 дней после инокуляции сока вызывает очень слабые симптомы. Системные симптомы у всех хозяев состоят из проходящей хлоротичной сетчатости жилок на более молодых листьях и слабого искривления листьев. На инокулированных листьях огурцов и Gomphrena globosa могут развиваться слабые местные поражения.

Рис. 114. Вверху слева - типичные симптомы окаймления жилок на листе сорта Грей Рислинг. Желтые участки развиваются вдоль главных жилок, а затем распространяются дальше по пластинке. Внизу слева - слабое пожелтение вдоль мелких жилок на молодом листе того же растения. Оба листа сфотографированы осенью. Справа - плохое завязывание плодов на развивающейся кисти растения сорта Педро Ксиминес, зараженного окаймлением жилок
Возбудитель. Вирус-возбудитель имеет полиэдрическую форму с диаметром около 30 ммк. Его легко можно очистить после выделения из зараженных растений Chenopodium quinoa [276].
Итальянский штамм, определенный путем заражения С. quinoa, обладает следующими физическими свойствами: температура инактивации 62 - 64°С; предельное разведение от 1 : 5000 до 1 : 10000; долговечность in vitro 9 - 12 дней при 23°С [192].
К калифорнийскому штамму получена антисыворотка с титром 1 : 256 [276].
Передача. В природе вирус окаймления жилок передается через почву; может передаваться также прививкой, окулировкой и механической инокуляцией. Имеются веские доказательства, что переносчиком этого вируса служит нематода Xiphinema index [137].
Механическая передача вируса от винограда травянистым растениям осуществима лишь в том случае, если листья растирают в щелочном буфере или в присутствии никотинового основания [54, 98]. Механическая передача виноградным лозам от зараженных травянистых растений или из очищенного препарата затруднительна, но, если тест-растения выращивать в условиях, вызывающих этиолирование (освобождение листьев от хлорофилла), можно добиться успеха [162, 276].
Непосредственная связь между окаймлением жилок и его переносчиком не доказана. Однако в силу тесной взаимосвязи вирусов окаймления жилок и короткоузлия можно ожидать, что взаимодействие вируса окаймления с переносчиком носит такой же характер, какой описан для короткоузлия [228, 274] (см. стр. 298).
Распространение в естественных условиях. В природе вирус окаймления жилок обычно связан с вирусами короткоузлия и желтой мозаики и распространяется также через почву. При медленном распространении болезни из очагов инфекции образуются более или менее округлые участки, занятые пораженными виноградными кустами. Скорость распространения различается в разные годы и может повыситься при выкорчевке больных кустов.
Переносчик широко распространен в Европе и Калифорнии и встречается лишь в очень ограниченных районах Австралии, где были высажены привитые виноградные лозы, ввезенные из Европы в виде окорененных растений.
Меры борьбы. Борьба заключается в уничтожении переносчика в зараженных районах и пересадке виноградников лозами, свободными от вируса. Но высаживать виноград на этих (зараженных) почвах можно не раньше чем через 5 лет, что обычно совершенно неэкономично. На участках, где виноград никогда раньше не сажали, необходимо следить, чтобы вирус и переносчик не были занесены с посадочным материалом.
Терапия. Тепловая обработка лоз при 38°С в течение 30 дней и последующее использование для размножения верхушечных черенков длиной 2,5 - 5 см обеспечивает получение высокого процента растений, свободных от вируса.
Примечания. На участках, зараженных переносчиком, необходимо исследовать возможность применения в качестве меры борьбы защиты слабыми штаммами [273]. Необходимо тщательно убедиться в правильности диагноза окаймления жилок; эту болезнь можно смешать с пожелтением жилок или с желтой мозаикой [137]. В Австралии на всех клонах Уолтхем Кросса появляются типичные симптомы окаймления жилок, но на сорте Сент-Джордж или на травянистых индикаторах, инокулированных штаммом из Уолтхем Кросса, не удалось вызвать реакции, присущие данному вирусу. Блаттни (личное сообщение) утверждает, что такая же картина наблюдается в отношении некоторых сортов в Чехословакии.
Обнаружение и идентификация. Первоначальное обнаружение связано с появлением на растениях в поле в течение лета и осени симптомов окаймления жилок. У некоторых сортов симптомы развиваются только на немногих листьях. Эту болезнь нельзя смешать с желтой мозаикой, вызывающей весной широкое пожелтение листьев и побегов, но легко спутать с пожелтением жилок, для которого характерны очень сходные симптомы [НО]. Однако кусты винограда, пораженные пожелтением жилок, бывают значительно крупнее здоровых, в то время как кусты, пораженные окаймлением жилок, мельче.
Все диагнозы необходимо подтверждать инокуляцией индикаторных сортов винограда прививкой. Сорт Сент-Джордж реагирует появлением линейного узора и посветления жилок, тогда как на сортах Мисьон и Бессемянный Томпсона появляется типичное желтое окаймление жилок. Реакция может развиться через 4 - 6 недель, но тест-растения должны оставаться под наблюдением в течение всей второй весны после инокуляции. Инокуляцию можно проводить, вставляя спящие глазки в развивающиеся или спящие черенки-индикаторы [166] или прививкой зеленых черенков [277].
Механическая инокуляция травянистых индикаторов также является результативным и быстрым методом дифференциации вирусов окаймления и пожелтения жилок. Последний вирус вызывает местные поражения и деформацию верхушки у Chenopodium аmaranticolor [143], в то время как вирус окаймления жилок - только очень слабое посветление сети жилок. На травянистых хозяевах дифференцировать вирусы окаймления жилок и желтой мозаики нелегко. Серологические методы также не позволяют разделить вирусы окаймления жилок, желтой мозаики и короткоузлия, хотя с их помощью легко дифференцировать окаймление и пожелтение жилок [140, 276].
ВИРУС МОЗАИКИ РЕЗУХИ НА VITIS
Синонимы. Нет. (Сокращенно AMV.)
История и географическое распространение. На первом собрании Международного совета по изучению вирусов и вирусных болезней винограда, происходившем в Нионе (Швейцария), Гертель и др. [133] сообщили об исследованиях, проведенных ими совместно с лабораторией Р. Беркса. В ходе этих исследований вирусы короткоузлия и мозаики резухи (типичная форма) были обнаружены с помощью серологических тестов в изолятах, выделенных из виноградной лозы [17]. Одновременно с этим первым сообщением о нахождении мозаики резухи на Vitis было установлено присутствие нематоды Xiphinema diversicaudatum (Micoletsky) - переносчика вируса мозаики резухи - в почве виноградников, зараженных этой болезнью (Б. Вейшер, 1964, личное сообщение). До того времени считалось, что X. diversicaudatum не играет никакой роли как переносчик вируса в виноградниках. В то же время Беркс и Штельмах [19] описали восемь мест (долины рек Нае, Мозеля и Рейна), где на винограде был обнаружен вирус мозаики резухи.
Экономическое значение. Специальная информация отсутствует, но болезнь, вероятно, имеет экономическое значение как часть комплекса возбудителей короткоузлия (Reisigkrankheit) n желтой мозаики (Panaschure), вирусных болезней винограда, передающихся через почву, в районах виноградарства ФРГ.
Круг растений-хозяев. а) Естественные хозяева [19]: Vitis vinifera АрамонХУ- riparia 143 AMG; Рислинг, Зейдектраубе и Сильванер; V. berlandieri X V. riparia Телецки 5С; V. solonis X V. vinifera Рислинг 157G X V. vinifera Рислинг FS-4-201-39 (Зигфридребе); V. vinifera Сильванер X Рислинг S88 (Шой-Ребе).
б) Экспериментальные хозяева (неопубликованные данные Штельмаха и Беркса): Сент-Джордж (Vitis rupestris); Chenopodium amaranticolor, С. murale и С. quinoa; сорт Химмельс-резхен Petunia hybrida.
Симптомы. а) Вирус был обнаружен в лозах Vitis vinifera, на которых имелись симптомы короткоузлия и желтой мозаики наряду с ослаблением роста сортов подвоев. Сведения о симптомах, специфичных для данного вида, отсутствуют. В дальнейшем должна быть проведена повторная передача чистого вируса незараженным лозам.
б) Симптомы, появляющиеся на экспериментально зараженных лозах сорта Сент-Джордж (V. rupestris), требуется точно определить.
На Chenopodium quinoa симптомы носят характер хлоротичных или некротических поражений на инокулированных листьях; системные симптомы начинают проявляться на молодых листьях в виде хлоротичного посветления жилок; позднее растение выздоравливает.
На С. murale симптомы проявляются в виде хлоротичных поражений на инокулированных листьях и системного посветления жилок и крапчатости; выздоровление не наступает. Иногда наблюдается деформация листьев. Вирус вызывает некротические кольцевые пятнистости на инокулированных листьях сорта Химмельсрез-хен (Petunia hybrida), хотя лишь после нескольких пассажей через травянистые растения; он вызывает и такие системные симптомы. как сильное некротическое посветление жилок. Позднее растение выздоравливает.
в) При комбинации с вирусами короткоузлия или черной кольцевой пятнистости томата (виноградный штамм) симптомы на винограде и травянистых растениях изменчивы и, вероятно, зависят от концентрации вирусов (неопубликованные данные Штельмаха и Беркса).
Возбудитель. Сок из растений Chenopodium quinoa, зараженных разными изолятами вируса из виноградной лозы, осаждался при реакции с антисывороткой к вирусу мозаики резухи так же, как гомологичный вирус, или очень сходно. Серологические реакции проводились по Охтерлони методом иммунодиффузии в геле [216]. Антигены были частично очищены; иногда использовался осветленный сок зараженных растений С. quinoa. В зараженных тепличных виноградных лозах вирус был обнаружен модифицированным методом флокуляции бентонита непосредственно в соке [19, 36]. В взятых из виноградников лозах вирус мозаики резухи был обнаружен латексным методом в соке молодых и старых листьев [16] (Беркс, неопубликованные данные). Некоторые исследования показали, что в виноградных изолятах и в самих лозах вирус мозаики резухи можно обнаружить лишь случайно. Во многих случаях изоляты или виноградные растения, в которых был обнаружен вирус мозаики резухи, содержали также вирусы короткоузлия и (или) черной кольцевой пятнистости томата [18]. Не исключено, что изоляты или лозы, в которых серологическим методом был обнаружен единственный вирус, фактически содержали много вирусов. Сведения об интерференции между вирусами, обнаруженными в виноградных лозах, отсутствуют.
Передача. а) Вирус был передан винограду прививкой сближением от Chenopodium amaranticolor, использованного в качестве источника вируса. Вирус передается соком. Молодые листья винограда мацерируют в 2,5%-ном растворе никотина для повышения рН сока и ослабления инактивации вируса. К инокулюму добавляли абразивный корундовый порошок. Описанным методом вирус передавали от больных виноградных лоз различным травянистым тест-растениям (Штельмах, неопубликованные данные).
б) Сведения о взаимосвязях переносчика вируса и растения отсутствуют.
Распространение в естественных условиях. Болезнь распространяется с зараженным посадочным материалом и, вероятно, через нематоду Xiphinema diversicaudatum [342].
Меры борьбы. Избегать использования больного посадочного материала.
Терапия. Сведения о разработке способов лечения отсутствуют.
Обнаружение и идентификация. Для обнаружения и идентификации применяются серологические методы.
ВИРУС ЧЕРНОЙ КОЛЬЦЕВОЙ ПЯТНИСТОСТИ ТОМАТА НА VITIS
Синонимы. Нет. (Сокращенно TBRV.)
История и географическое распространение. В 1962 и 1963гг. yа кустах подвоев сорта Vitis vinifera Арамон Х V. rioaria 143AMG, произраставших в винограднике около Трира (район Мозеля в ФРГ), были обнаружены неспецифическое временное ослабление роста, отклонения в окраске листьев и сужение пластинок листьев. Возникло подозрение, что кусты поражены вирусом. Молодые листья с ненормальных лоз были проверены механической инокуляцией Chenopodium и Nicotiana, используемых в качесте тест-растений для выявления возможных вирусных поражений. Симптомы, развившиеся на этих растениях, свидетельствовали, что лозы заражены вирусом кольцевой пятнистости. Серологические тесты, проведенные для идентификации вируса, установили, что выделенный из лоз вирус является одним из штаммов вируса черной кольцевой пятнистости томата [265]. Рядом с сильно зараженными кустами винограда были обнаружены нематоды из рода Longidorus, а вид L. attenuatus Hooper был определен как переносчик вируса, хотя в винограднике встречалась также L. vineacola Surhan et Weischer [341]. До сего времени вирус черной кольцевой пятнистости томата был обнаружен только в ФРГ. Описано шесть участков, где этот вирус встречался на винограде, нередко в смешанной инфекции с вирусом короткоузлия и мозаики резухи (типичная форма) [19].
Экономическое значение. Лозы, привитые в питомнике на зараженные подвои, погибают в больших количествах после тепличной выгонки. Если бы удалось доказать, что из молодых прививок вирус черной кольцевой пятнистости томата в значительной мере удалялся, его можно было бы считать относительно безвредным вирусом. Но он был обнаружен также и в лозах из других районов. Возможно, этот вирус является частью смешанного комплекса возбудителей короткоузлия и желтой мозаики, двух передающихся через почву вирусных болезней винограда в районах виноградарства ФРГ.
Круг растений-хозяев. а) Естественные хозяева [19]: Vitis vinifera Арамон X V. riparia 143AMG; Рислинг, Зейдентраубе и Сильванер; V. berlandieri X V. riparia Тел едки 5С.
б) Экспериментальные хозяева [266]: Vitis vinifera Цезарь; Рислинг X Сильванер (Мюллер-Тургау); V. rupestris Сент-Джордж; Vitis калифорнийской селекции LN-33 N. F. A4V3.
Aizoaceae: Tetragonia expansa. Amaranthaceae: Gomphrena globosa. Caryophyllaceae: Stellaria media. Chenopodiaceae: Atriplex hastata, A. hortensis, A. littoralis, A. nitens, A. rosea; Chenopodium amaranticolor, C. murale, C. polyspermum, C. quinoa. Cucurbitaceae: Cucumis sativus; Cucurbita pepo. Solanaceae: Nicotiana clevelandii, N. debneyi, N. glutinosa; N. tabacum Гавана 424, Самсун, Т 1787, Вирджин Голд А и Уайт Барлей; Petunia hybrida Химмельсрезхен и Ред Сэтин.
Симптомы. а) В винограднике, где был обнаружен вирус черной кольцевой пятнистости томата, у подвоев сорта Vitis vinifera Арамон X V. riparia 143AMG наблюдалось временное ослабление роста. В многих случаях было отмечено выздоровление растений, также наблюдались задержка роста и карликовость. На более старых листьях отмечались крапчатость, пожелтение краев и морщинистость. У молодых листьев наблюдалось сужение пластинки. Кусты со слабо выраженными симптомами или бессимптомные также были поражены этим вирусом. Массовая проверка отдельных кустов обнаружила 40%-ную зараженность [266]. Как только будет проведена экспериментальная повторная передача чистого вируса свободным от вируса кустам винограда, необходимо составить описание специфических симптомов поражения вирусом черной кольцевой пятнистости томата его естественных хозяев.

Рис. 115. Лист гибрида vinifera Арамон х Xriparia 143AMG с симптомами хлоротичной кольцевой пятнистости и хлороза, вызванными вирусом черной кольцевой пятнистости томата

Рис. 116. Вверху - лист Nicotiana tabacum Т1787 с симптомами поражения вирусом черной кольцевой пятнистости томата, выделенным из виноградной лозы. Внизу - листья Petunia hybrida Химмельсрезхен со слабо выраженными хлоротичными пятнами, вызванными вирусом черной кольцевой пятнистости томата, который был выделен из виноградной лозы
б) В опытах с первоначально свободными от вируса подвоями сорта АрамонХ 143АМС (частично этиолированными молодыми кустами, зараженными механической инокуляцией вирусом черной кольцевой пятнистости томата Хьюитт и Кори [162] установили, что на молодых листьях появились симптомы хлоротичной кольцевой пятнистости предположительно вследствие шоковой реакции (рис 115) На листьях, сформировавшихся позднее, симптомы отсутствовали [264]. Симптомы, появляющиеся на старых кустах винограда, зараженных таким же способом, предстоит еще определить.
На инокулированных листьях Chenopodium quinoa симптомы имеют вид некротических колец, позднее превращающихся в некротические пятна. На молодых листьях системный симптом представлен крапчатым обесцвечиванием. Вирус вызывает на инокулированных листьях C. murale зональную кольцевую пятнистость, которая позднее некротизируется, и системное посветление жилок. Иногда наблюдается некроз верхушек. На Nicotiana clevelandii вирус черной кольцевой пятнистости томата (виноградный штамм) вызывает некротические кольцевые пятна на инокулированных листьях и системные кольцевые симптомы. Позднее все растение целиком выздоравливает. Очень тяжелые системные симптомы типа линейного узора появляются на N. tabacum T1787 (рис. 116, вверху). На Petunia hybrida Химмельсрезхен (рис. 116, внизу) отмечалась только слабая крапчатость [266].
в) Симптомы комплексного поражения винограда и травянистых растений вирусами короткоузлия и (или) мозаики резухи изменчивы и, вероятно, зависят от концентраций вируса (Штельмах и Беркс, неопубликованные данные).
Возбудитель. Сок из растений Petunia hybrida Химмельсрезхен, зараженных виноградным изолятом из гибрида АрамонХ143АМС, специфически осаждается антисывороткой к типичной форме вируса кольцевой пятнистости томата и к другим штаммам этого вируса [265]. Сок из растений Chenopodium quinoa, зараженных различными виноградными изолятами, также давал специфическую реакцию с теми же антисыворотками. Эти серологические реакции проводились методом иммунодиффузии в агаровом геле по Охтерлони [210]. Антигены были частично очищены; иногда использовался осветленный сок зараженных растений P. hybrida или С. quinoa. В растениях винограда, зараженных вирусом и содержавшихся в теплице, вирус черной кольцевой пятнистости томата при помощи модифицированного метода флоккуляции бентонита был обнаружен непосредственно в соке молодых листьев [19, 36]. В виноградниках вирус был выявлен латексным методом в соке молодых и более старых листьев [16; Беркс, неопубликованные данные]. Некоторые исследования показали, что присутствие вируса черной кольцевой пятнистости томата в изолятах из виноградной лозы и в самих растениях можно обнаружить лишь случайно. Изоляты или растения винограда, в которых был обнаружен этот вирус, во многих случаях содержали вирусы короткоузлия и (или) мозаики резухи [18]. Возможно, что изоляты пли растения винограда, в которых серологическим методом был обнаружен только один вирус, фактически содержали большее число их. Данные об интерференции между вирусами в растениях винограда отсутствуют.
Передача. а) Вирус черной кольцевой пятнистости томата был передан от одного растения винограда другому обычной зимней прививкой (на столе), прививкой сближением от Chenopodium amaranticolor, используемого в качестве источника вируса, и механической инокуляцией этиолированным растениям винограда [162] и травянистым хозяевам [265]. Были предприняты попытки заразить вирусом черной кольцевой пятнистости томата приманочные растения, выращиваемые в почве, взятой из ризосферы зараженных кустов винограда. Зараженными оказались только корни приманочных растений. Вирус был выделен из корней первоначально свободных от вируса кустов сорта Vitis vinifera Фербертраубе (Тейн-тюрье), выращенных в зараженной почве [264]. В образцах зараженной почвы были найдены нематоды Longidorus vineacola Surhan et Weischer и L. attenuatus Hooper [341]. Они были выделены и перенесены в сосуды, содержащие не зараженную вирусом почву; затем в эти сосуды высадили не зараженные вирусом сеянцы сорта
Cucumis sativus Деликате. У растений, выросших на почве, заселенной выбранными вручную экземплярами L. attenuatus, были поражены вирусом черной кольцевой пятнистости томата только корни. В одном опыте нематод разделили на взрослых самцов, взрослых самок и личинок. Заражение происходило только через взрослых самок. Открытие того, что L. attenuatus является переносчиком, означает, что виноградный штамм вируса черной кольцевой пятнистости томата нужно отнести в ту же группу штаммов, что и вирус кольцевой пятнистости латука и английский штамм.
б) Установлено, что мокрица (Stellaria media] вблизи сильно пораженных кустов винограда, растущего на песчаной почве, была сильно заражена вирусом черной кольцевой пятнистости томата. Семена также были заражены; вирус был обнаружен в очень молодых сеянцах, проросших на вермикулите [Штельмах, неопубликованные данные; 184]. Нет сомнения в том, что рассеивание семян S. media способствует распространению вируса. Удалось показать, что V. vinifera Арамон X У" riparia 143AMG и V. rupestris Сент-Джордж восприимчивы к штаммам вируса черной кольцевой пятнистости томата из персика (Prunus persica) и черешни (P. avium) [264]. Это создает некоторые проблемы, связанные со вспышками эпифитотий. Для того чтобы эффективно передавать вирус черной кольцевой пятнистости томата, нематоды должны, по-видимому, повторно иметь доступ к источнику инфекции. Переносчик сохраняет способность инокулировать растения примерно девять недель [342]. Сведения о продолжительности инкубационного периода в листьях винограда отсутствуют.
Распространение в естественных условиях. Виды Longidorus встречаются повсюду в более теплых зонах, но найдены также в ФРГ; L. attenuatus обитает в легких почвах и была обнаружена на севере ФРГ. В виноградниках L. attenuatus до настоящего времени найдена только в районе Трира, ФРГ. В этой зоне в течение ряда лет выращивались овощные культуры и были заложены питомники. На винограде вирус черной кольцевой пятнистости томата был впервые обнаружен в одном из местных виноградников [265]. Позднее серологические тесты подтвердили правильность этого первого сообщения о нахождении вируса черной кольцевой пятнистости томата в виноградных лозах, но нематода L. attenuatus не была обнаружена [19]. Это может означать, что вирус распространился на винограде в основном в результате интродукции зараженного материала. Но первоначальное заражение винограда должно было произойти при участии естественного переносчика.
Меры борьбы. Там, где переносчик отсутствует, использование незараженного посадочного материала должно полностью исключить вирус черной кольцевой пятнистости томата из новых виноградников.
Терапия. Сведения о способах лечения отсутствуют.
Обнаружение и идентификация. Для обнаружения и идентификации применяются серологические методы.
ВЕНГЕРСКАЯ ХРОМОВАЯ МОЗАИКА (HUNGARIAN CHROME MOSAIC)
Синонимы. Sarga mozaik.
История и географическое распространение. Болезнь, несомненно, давно уже существует в Венгрии, но ее, по-видимому, смешивали с недостаточностью железа, которая широко распространена в этой зоне. Одно из первых сообщений принадлежит д-ру И. Барра, который наблюдал ее в 1932 г. и считал, что она представляет собой физиологическое расстройство. Систематическое изучение хромовой мозаики было начато в 1962 г. [18, 247]. Болезнь сосредоточена главным образом в виноградниках на северном берегу озера Балатон, где она была обнаружена в 1966 г. в 30 различных местностях. Небольшое число изолированных кустов с кремово-желтыми изменениями окраски было недавно отмечено в зоне юго-восточнее Будапешта (Катонателеп, Кечкемет). В районе Токая этот синдром ни разу не был отмечен. Причина локализации болезни в определенном районе виноградарства не известна, но исследуется возможность связи ее с присутствием переносчиков.
Экономическое значение. В силу ограниченного распространения мозаика в настоящее время не представляет серьезной проблемы. Но потенциально она, несомненно, опасна, так как пораженные лозы не плодоносят и в конце концов могут погибнуть.
Круг растений-хозяев. Естественно зараженными оказались 33 различных сорта Vitis vinifera и, кроме них, следующие подвои и гибриды: V. berlandieri X V. riparia Кобер 5ВВ; V. riparia Порталис; V. vinifera Арамон X V. rupestres Gl; V. labruscay V. riparia Hoax; V. labrusca X V. riparia X V. vinifera Отелло; V. rupestris Дюло. Тип и интенсивность проявления симптомов на всех этих видах и сортах различаются незначительно.
Симптомы. Для симптомов характерны резкие изменения окраски листьев, которые рано весной бывают хромово-желтыми или беловатыми. Эти изменения окраски могут распространяться по всей пластинке листа или ограничиваться крупными секторами ее или только тканями, прилегающими к жилкам. Иногда окраска листьев изменяется только на одном рукаве куста, а все остальные листья сохраняют нормальный зеленый цвет. Возможны деформации листьев и побегов (раздвоение, двойные узлы, короткие междоузлия). В ксилеме встречаются трабекулы. Больные кусты развиты значительно слабее, чем здоровые; состояние их постепенно ухудшается, что приводит к отсутствию плодоношения и в конечном счете к окончательной гибели через 5 - 6 лет.
Возбудитель. С данной болезнью оказался связанным изодиаметрический вирус, передающийся соком; диаметр его частиц равен примерно 30 ммк [183, 190, 193, 247]. Этот инфекционный агент по реакции некоторых травянистых хозяев на заражение (например, Phaseolus vulgaris, Datura stramonium, Gomphrena globosa) можно отделить от других передающихся соком вирусов, поражающих виноградную лозу (вирусы короткоузлия винограда и пожелтения жилок, мозаики резухи и черной кольцевой пятнистости томата). Серологически этот агент не близок, по-видимому, ни к одному из перечисленных вирусов. Изучение его физических свойств in vitro в зараженном соке Chenopodium quinoa показало, что предельное разведение равно 10-2 - 10-3; точка термической инактивации 60 - 65°С; долговечность in vitro 6 - 10 дней. Физико-химические свойства еще не изучены. До сих пор этот вирус не удалось отделить от других инфекционных агентов, выделенных из венгерских лоз, на которых скорее заметны макроскопические симптомы короткоузлия, чем хромово-желтые изменения окраски.
До сих пор экспериментально не доказано, что вирус является фактическим возбудителем болезни.
Передача. Болезнь удалось успешно передать прививкой больного сорта Ред Вельтлайнер на бессимптомные кусты Szeremi Zold и Итальянского Рислинга и от зараженного Szeremi Zold - бессимптомному Ред Вельтлайнеру. Примерно за год удалось полностью воспроизвести весь синдром.
Распространение в естественных условиях. Полевые наблюдения подтверждают, что болезнь передается через почву. Пораженные растения распространяются в виноградниках пятнами. Бессимптомные растения, высаженные на место выкорчевки старых зараженных растений, в свою очередь, заболевали. Нематода Xiphinetna vuittenezi была найдена во всех исследованных очагах заражения желтой мозаикой. В одном случае, наряду с нематодами этого вида, было найдено несколько экземпляров Xiphinema index. Связь с естественным распространением болезни в настоящее время исследуется.
Меры борьбы. Данные отсутствуют.
Терапия. Данные отсутствуют.
Примечания. Внешние проявления венгерской хромовой мозаики практически неотличимы от симптомов желтой мозаики. Поэтому диагноз болезни в полевых условиях затруднителен. Различие между болезнями заключается в том, что первая часто бывает смертельной для хозяина и сильно снижает способность черенков к окоренению и каллюсообразованию. Кроме того, в затененных условиях теплицы симптомы болезни продолжают развиваться на новых листьях кустов, пораженных хромовой мозаикой, но на растениях с типичными проявлениями желтой мозаики симптомы больше не появляются.
Поскольку различить обе болезни трудно, а экспериментальные данные еще явно недостаточны, в настоящее время невозможно установить, встречается ли в Венгрии типичная желтая мозаика. Но можно надеяться, что ведущиеся исследования обеспечат получение необходимых сведений.
Обнаружение и идентификация. Болезнь выявляют на основании симптомов, обнаруженных в полевых условиях (изменение окраски до хромово-желтой или беловатой, потеря мощности роста, постепенное ухудшение общего состояния, бесплодие), и идентифицируют на травянистых индикаторных растениях. В настоящее время ведутся поиски древесных индикаторов.
ПОЖЕЛТЕНИЕ ЖИЛОК (GRAPEVINE YELLOW VEIN)
Синонимы. Болезнь имеет только одно название - пожелтение жилок. Но сходные симптомы описаны для нескольких болезней неизвестной этиологии [22, 237, 240]. (Сокращенно GYVV.)
История и географическое распространение. Пожелтение жилок впервые описал Хьюитт [158], указавший, что его вызывает агент, передающийся прививкой. Сообщения о болезни имеются только из Калифорнии [143].
Экономическое значение. Для промышленного виноградарства пожелтение жилок не имеет экономического значения по крайней мере в свете современных знаний о встречаемости и географическом распространении этой болезни. Но в отдельных виноградниках она может иметь важное значение, так как поражает от 15 до 20% кустов, которые вследствие этого почти или совсем не плодоносят.
Круг растений-хозяев. Естественные хозяева: Vitis vinifera L., сорта Кариньян, Гренаш, Вальдепеньяс и Имперор.
Экспериментальные хозяева. Amaranthus hybri-dus L., Gomphrena globosa L., Chenopodium album L., C. amarantico-lor Coste et Reyn., C. capitatum (L.) Asch., C. quinoa Willd., Cucumis salivas L., Cucurbiia maxima Duchesne, Phaseolus vulgaris L., P. limensis Macfadyen, Vigna sinensis (Tomer) Savi, Datura stramonium L., Nicotiana rustica L., N, tabacum L., Petunia hybrida Vilm.
Симптомы.На естественных хозяевах a) Vitis vinifera, сорта Кариньян, Гренаш и Вальдепеньяс. Наиболее постоянным симптомом является слабое завязывание плодов на гроздьях первого урожая или почти полное отсутствие его; грозди второго урожая нормальные. Форма цветков и характер цветения больных кустов внешне нормальные, но пыльца менее жизнеспособна, чем у здоровых [143]. На отдельных гроздьях ягоды совсем не образуются, или завязываются в меньшем числе нормальные и бессемянные ягоды (рис, 117, вверху). В связи с этим грозди имеют очень беспорядочный вид. Ножки тех гроздей, на которых ягоды не развиваются, буреют и отмирают. Степень проявления симптомов на листьях и число листьев, на которых эти симптомы проявляются, широко варьируют на разных кустах. На некоторых лозах симптомы образуются только на 1 - 2 листьях, даже при наличии симптомов на плодах. На других может оказаться много листьев с ясно выраженными симптомами.
Первоначальные симптомы на инокулированных растениях представлены слабой хлоротичной крапчатостью и линейным узором, который может иметь неправильную кольцевидную форму или форму дубовых листьев. В естественно зараженных виноградниках эти узоры встречаются редко. Наиболее обычные симптомы на листьях имеют вид хромово-желтых пятен, разбросанных по пластинке, и желтых пятен шагреневой структуры, расположенных вдоль жилок (рис. 117, внизу). Хромово-желтая пятнистость и желтое окаймление жилок могут встречаться одновременно на одном и том же листе или раздельно на разных-листьях. Желтая окраска часто сильнее выражена весной и в начале лета, но к концу сезона бледнеет и белеет, особенно на листьях, непосредственно обращенных к солнцу.
Больные кусты часто крупнее нормальных. Эта особенность в сочетании с отсутствием плодов обусловила обиходное название "бычий виноград". Усиление вегетативного роста является, вероятно, результатом отсутствия завязывания плодов на больных кустах.
б) Vitis vinifera, сорт Имперор. На сорте Имперор развиваются те же симптомы, которые описаны для Кариньяна, Гренаша и Вальдепеньяс, но желтые пятна вдоль жилок сливаются, образуя непрерывную полосу.
На экспериментальных хозяевах. Amaranthaceae. Amaranthus hybridus. Вслед за светло-желтыми местными поражениями появляется системное окаймление жилок. Через 2-3 недели после инокуляции все растение принимает темно-красную окраску.
Gomphrena globosa. На инокулированных растениях явные симптомы не развиваются, но.вирус легко можно выделить из инокулированных или новых листьев.
Chenopodiaceae. Chenopodium amaranticolor. Местные поражения до 2 мм в диаметре появляются в виде хлоротичных пятен с красновато-бурыми краями через 3 - 5 дней после инокуляции. Увеличиваясь в размерах, они превращаются в хлоротичные концентрические или эксцентрические пятна шириной 3-5 мм. Симптомы системного заражения проявляются сначала в виде светло-желтых крапин или пятен на верхушечных листьях, которые вскоре скручиваются и деформируются. Затем вся верхушка побега сгибается под острым углом и некротизируется (рис. 118, слева). На листьях, расположенных на побеге между инокулированным листом и некротизированной верхушкой, через 2 - 3 месяца развивается пожелтение жилок, а стебли и черешки становятся темно-красными. Из боковых почек часто развиваются новые побеги, придающие растениям вид "ведьминых метел".
Chenopodium album, С. capitatum и С. quinoa. Симптомы сходны с описанными для С. amaranticolor, но окраска не изменяется.
Cucurbitaceae. Cucumis sativus, сорт Нэйшнл Пиклинг. На инокулированных семядолях развиваются желтоватые местные поражения; в дальнейшем семядоли становятся целиком хлоротичными и отпадают. Системные симптомы выражаются хлоротичными пятнами.
Cucurbita maxima, сорт Летний Желтый Крукнек. Первые симптомы состоят из хлоротичных колец на инокулированных семядолях, которые позднее целиком желтеют, отмирают и отпадают. Системные симптомы выражены бледной хлоро-тичной пятнистостью.
Leguminosae. Phaseolus vulgaris, сорт Барпис Стринглесс Грин Под. На инокулированных первичных листьях через 4 - 6 дней после инокуляции образуются кольцевой и линейный узоры. На первом и втором тройчатых листьях развиваются многочисленные некротизированные жилки, а самые листья деформируются. Третий и четвертый тройчатые листья обычно нормальные по величине и форме, но на них образуются хлоротичные пятна, кольцевой и линейный узоры.
Phaseolus limensis (лимская фасоль). На инокулированных листьях появляются хлоротичные кольца. Системные симптомы выражены сильным некрозом жилок и прекращением роста.
Vigna sinensis. На инокулированных листьях развиваются слабо выраженные хлоротичные пятна или кольца. Системные симптомы представлены слабой крапчатостью. Телиц и др. [279] использовали коровий горох для отделения вируса пожелтения жилок винограда от типичной культуры вируса кольцевой пятнистости томата и вируса пожелтения почек персика. Два последних вируса вызывают некроз верхушек коровьего гороха.
Solanaceae. Datura stramonium. На инокулированных листьях развиваются светлые хлоротичные пятна. Системные симптомы представлены очень слабой крапчатостью.
Nicotiana tabacum. На сорте Мэриленд Мамот и на Турецком табаке появляются одинаковые симптомы. Через 3 - 5 дней после инокуляции развиваются хлоротичные кольца. Системные симптомы, состоящие из хлоротичных кольцевых и линейных узоров, развиваются через 7 - 14 дней после инокуляции (см. рис. 118, справа).
Nicotiana rustica. Симптомы сходны с появляющимися на N. tabacum, но системные кольца более многочисленные.
Petunia hybrida. Хлоротичные пятна и диффузные кольца развиваются на инокулированных листьях через 4 - 6 дней после инокуляции. Системные симптомы состоят из хлоротичных колец и линейных узоров.
Растения, очевидно, иммунные. Nicotiana glutinosa L., Capsicum frutescens L., сорт Калифорнийское Чудо; Solanum melongena L., сорт Блэк Бьюти; Zinnia elegans Jacq; Brassica pekinensis (Lour.). Rupr.

Рис. 117. Вверху - симптомы заражения винограда сорта Кариньян пожелтением жилок: слева - кисть со здорового куста; справа - кисти, пораженные болезнью, крупные ягоды на больных кистях имели нормальный размер и содержали семена, но их не было в мелких круглых ягодах. Внизу - симптомы пожелтения жилок на листьях сорта Кариньян - общая хромово-желтая пятнистость и желтые пятна шагреневой структуры вдоль жилок

Рис. 118. Слева - симптомы системного заражения Chenopodium amaranticolor вирусом пожелтения жилок винограда в виде пятен на верхушечных листьях, деформации листьев и сгибания под острым углом верхушки побега. Справа - симптомы системного заражения этим вирусом листьев табака - отчетливо видны кольцевые и линейные узоры
Возбудитель. Хьюитт [158] сообщал, что возбудитель (или возбудители) пожелтения жилок винограда передается прививкой. На основании ряда опытов Гудинг и Хьюитт [143], Гудинг [140], Гудинг и др. [144] доказали, что единственным возбудителем болезни является вирус.
Этот вирус имеет "сферическую" форму при диаметре 28±2 ммк. Серологически он близок к вирусам пожелтения почек персика и кольцевой пятнистости томата [140, 279].
Изучение тепловой инактивации, выстаивания in vitro и предельного разведения вируса в неочищенном соке системно зараженных листьев Phaseolus vulgaris дало следующие результаты: 1) точка тепловой инактивации: между 60 и 62°С; 2) выстаивание in vitro - 6 - 8 дней при 22°С; 3) предельное разведение: между 10-3 и 10-4.
На основании физических и биологических свойств вируса его считают штаммом вируса кольцевой пятнистости томата.
Передача. Вирус пожелтения жилок винограда передается прививкой сортам Vitis vinifera: Имперор, Вальдепеньяс, Кариньян и Гренаш. Его можно также механически передать от винограда травянистым растениям и от растений табака и фасоли к винограду [140, 143].
Вирус можно выделить из пыльцы больных растений винограда. Гудинг и Хьюитт [143] установили, что у больных кустов только
12% пыльцы жизнеспособно по сравнению с 51% жизнеспособной пыльцы у здоровых растений. Но передача болезни от одного куста другому через пыльцу не доказана.
Вирус пожелтения жилок винограда можно передать от одного растения огурца другому через нематоду Xiphinema americanum Cobb [278, 279]. Серологически вирус близок к вирусу пожелтения почек персика и к типичному штамму вируса кольцевой пятнистости томата [140, 279]. Все три вируса передает нематода X. americanum. Изучение взаимосвязей вируса и переносчика проводили только в опытах с типичным штаммом кольцевой пятнистости томата [279].
Вирус могла передать одна нематода, хотя передачу его всем подопытным растениям удалось осуществить только при посредстве 100 нематод. Личинки и взрослые особи были одинаково эффективны в передаче вируса.
Переносчики воспринимали его в течение часа и передавали также в течение часа. Осталось еще доказать, что X. americanum передает вирус пожелтения жилок винограда от одного растения винограда другому.
Распространение в естественных условиях. Появление пожелтения жилок в том или ином винограднике обусловлено, по-видимому, использованием зараженного вирусом растительного материала для прививок или для закладки новых, виноградников. Телиц и др. [279] сообщают о винограднике, в котором болезнь продолжает распространяться. На всей площади виноградника была обнаружена Xiphinema americanum. Поскольку эта нематода передает вирус растениям огурцов, она может, очевидно, служить естественным переносчиком вируса пожелтения жилок винограда. В этом случае медленное распространение болезни можно объяснить низкой эффективностью нематоды как переносчика или слишком продолжительным инкубационным периодом после инокуляции.
Меры борьбы. На основе современных знаний болезнь можно полностью искоренить, используя только незараженный материал для размножения. Но Телиц и др. [279] сообщают, что Хыоитт недавно наблюдал распространение болезни в одном из виноградников.
Если она распространялась при посредстве X. americanum, которая переносит вирус с одного огуречного растения на другое, то потребуются, разумеется, иные меры борьбы.
Обнаружение и идентификация. На основании симптомов можно лишь пытаться идентифицировать пожелтение жилок, поскольку такие же симптомы вызывают и некоторые другие вирусные и невирусные болезни винограда. Особенно легко спутать пожелтение жилок с окаймлением жилок. Гохин и Хыоитт [1371 сравнили симптоматологию пожелтения жилок и окаймления жилок. Из других вирусных болезней пожелтение жилок можно спутать со слабыми формами желтой мозаики и хромово-желтыми формами ко-роткоузлия.
Симптомы пожелтения жилок на гроздьях сходны с симптомами, вызываемыми некоторыми, по-видимому, вирусными болезнями. Хьюитт [156] использовал термин "неплодоносность" при описании снижения завязывания плодов, вызываемого вирусными и другими болезнями, например мелколистностью. Термин "осыпание" (coulurе) применялся во Франции и в Северной Америке в отношении неплодоносных кустов винограда [22, 237, 240]. Осыпание чаще всего приписывали действию факторов питания, наследственных или окружающей среды. Иногда симптомы пожелтения жилок очень сильно проявляются на плодах, в то время как на листьях отсутствуют. Именно в этих условиях пожелтение жилок легче всего спутать с другими факторами, обусловливающими неплодоносность. В сомнительных случаях вирус пожелтения жилок винограда можно обнаружить и идентифицировать путем прививки на определенные индикаторные сорта винограда или путем механической передачи его травянистым растениям.
а) Прививка. Вирус можно передать прививкой сортам Имперор, Вальдепеньяс, Кариньян и Гренаш, но это не удается в отношении сорта Сент-Джордж (V. rupestris) или гибрида Кобер 5ВВ. Вирусы желтой мозаики, окаймления жилок и короткоузлия можно передать прививкой всем этим сортам. Главный недостаток этого способа идентификации пожелтения жилок заключается в том, что на окулированных в приклад кустах симптомы проявляются только через 2 - 3 года.
б) Механическая передача. Наиболее быстрый метод идентификации вируса пожелтения жилок винограда - механическая инокуляция травянистых индикаторных растений вирусом из виноградных лоз. Если требуется установить идентичность вируса, в качестве индикаторов рекомендуется использовать Nicotiana tabacum или N. rustica и Chenopodium amaranticolor. Если же вирус идентифицирован и требуется только его обнаружить, рекомендуется использовать С. quinoa, как наиболее чувствительный из всех его растений-хозяев, например при исследовании распределения вируса в различных частях растения. Превосходным источником вируса для серологической идентификации методом иммунодиффузии служит системно зараженный Cucumis sativus.
Важным фактором успешного использования травянистых индикаторов является источник инокулюма. Если используется материал, взятый в поле, он должен состоять из молодых побегов длиной 1 - 6 см, собранных весной в начале отрастания лоз. Вирус пожелтения жилок также можно легко выделить из побегов, собранных в любое время года, путем выгонки черенков с одним глазком в вермикулите при 35 - 37°С. Листья или корни, развивающиеся на черенках, служат отличными источниками инокулюма. Для передачи вируса нужно мацерировать ткань в нейтральном 0,1 М фосфатном буфере (1 г ткани на 2 мл буфера) и натереть полученной кашицей листья, опыленные корундом.
ЛИСТОВИДНЫЕ ВЫРОСТЫ (ENATIONS)
Синонимы. Malattia delle enazioni; omeoplasie crestiformi; Enationen-Krankheit; enations de la vigne.
История и географическое распространение. Листовидные выросты у европейского винограда известны уже давно [52, 186, 187]. В Италии они были отмечены впервые в 1928 г. [238], а их гистологическое развитие было изучено почти на 10 лет позднее [135].
Изучая этиологию этого расстройства, Менкаччи [199] предполагал, что его вызывает клещ, тогда как Петри [220, 221, 223 - 225] не исключал возможности вирусной природы болезни, хотя не сумел передать ее прививкой.
Подробнее болезнь была изучена в Калифорнии, где Хьюитт [156] сделал интересное наблюдение, что она передается с материалом, используемым для размножения. Однако неудачные попытки передать болезнь прививкой здоровым лозам заставили Хьюитта и его коллег отнести ее в группу вирусоподобных болезней [156, 160, 166].
За последние несколько лет из Европы снова поступили сообщения о болезни "листовидные выросты" [149], тогда как полевые наблюдения все чаще указывали на ее вирусное происхождение [149, 166, 236]. Окончательное доказательство этого было получено в результате удачной передачи болезни прививкой, достигнутой в Италии [191]. Листовидные пролиферации встречаются в некоторых европейских странах (Италия, ФРГ, Венгрия), в США, Южной Африке и в Австралии.
Экономическое значение. Отсутствие точных данных затрудняет оценку значения болезни. Серьезные убытки, вызванные катастрофическим снижением урожая и низким качеством его, были отмечены в Южной Италии в виноградниках, состоявших из наиболее восприимчивых сортов (например, Пане ранний).
Круг растений-хозяев. Болезнь поражает многие сорта Vitis vinifera. Некоторые из них, например Пане ранний, Праймас, Италия и Рислинг в Европе и Токай и Гренаш в Калифорнии, по-видимому, чрезвычайно восприимчивы, и симптомы проявляются на них особенно сильно. После искусственного заражения симптомы развиваются также и на американских подвоях (например, на V. berlandieri X V. riparia Кобер 5ВВ).
Симптомы. а) Общий вид. Замедленное распускание почек и медленное развитие побегов придает весной пораженным лозам кустистый вид. В течение лета зеленые органы постепенно начинают развиваться нормально. Один из характерных признаков болезни - непостоянство проявления симптомов на одних и тех же растениях в течение ряда лет.

Рис. 119. Молодой побег сорта Италия (Vitis vinifera), видны типичные листовидные новообразования на нижней поверхности листьев, а также деформации листьев и жилок
б) Симптомы на листьях. Выросты развиваются обычно на листьях у оснований побегов. Они представляют собой параллельные парные, прямые или извитые, пластинчатые выросты, образующиеся на нижней поверхности пластинки, в большинстве случаев расположенные параллельно более крупным жилкам. Эти листовидные выросты имеют различную длину (0,3 - 5 см) и высоту (2 - 3 мм). Мелкие чашевидные выросты разбросаны и между жилками. Форма листьев, несущих такие выросты, может быть сильно искажена: они бывают разделены на доли, искривлены, сильно изрезаны и иногда очень напоминают листья, поврежденные в результате обработки гормонами (2,4-Д) (рис. 119). Выросты не являются постоянными симптомами болезни, так как у некоторых сортов они часто отсутствуют или встречаются редко и только в некоторые годы. В таких случаях базальные листья бывают карликовыми, округленными, толще нормальных, с выпуклыми жилками. Наиболее сильно пораженные листья обычно имеют ограниченное развитие и опадают летом. Те, на которых выростов не слишком много, могут развиться до нормальных размеров, в то время как пролиферации уменьшаются или исчезают.
б) Симптомы на побегах. Побеги на пораженных кустах склонны иногда расти книзу, не будучи ни гибкими, ни мягкими. У некоторых сортов (Пане Ранний, Кардинал) основания побегов могут достигать ненормально крупных размеров. Нижние междоузлия короткие, уплощенные и деформированные, покрыты неправильными бороздами, гребнями и выростами. На узлах могут наблюдаться бластомы и пролиферации почек. В последнем случае в результате ненормального развития пазушных почек на их месте образуется множество выпуклых, шаровидных, белесоватых, напоминающих вату, выростов, которые часто сливаются в седловидные или подушкообразные образования, окружающие узлы. На нижних междоузлиях часто наблюдаются продольные трещины, которые появляются сначала в виде узких глубоких щелей, достигающих ксилемы, а затем превращаются в эллиптические буроватые язвы длиной до 6-7 см (рис. 119). Во внутреннем строении побегов, обладающих таким ненормальным видом, заметны глубокие нарушения. В коре часто встречаются одревесневшие узелки.
Возбудитель. Некоторые исследователи [51, 130, 149, 161, 189] сообщали о постоянном выделении из кустов винограда, пораженных листовидными выростами, штамма вируса короткоузлия, мало отличающегося по своим физическим и серологическим свойствам от обычных деформирующих штаммов этого вируса [228]. Однако эти результаты не согласуются с данными исследований, проведенных в Австралии, где из лоз, пораженных листовидными выростами, не были выделены вирусы, передающиеся соком (Р. Г. Тейлор, личное сообщение).
Из Италии имеются сообщения, что главную роль в этиологии этой болезни может играть вирус короткоузлия; в настоящее время взаимосвязь между этими болезнями изучается.
Передача. Болезнь была передана окулировкой внешне здоровых глазков сортов Пане ранний и Италия на пораженные лозы сорта Италия и прививкой здоровых "глазковых черенков" (щиток с глазком) тех же сортов и гибрида Кобер 5ВВ на окорененные черенки сорта Италия, пораженного выростами. Типичные симптомы появились через два года после прививки. В первом году вегетации были отмечены только сильные проявления короткоузлия [170]. Листовидные выросты развивались также [236] на растениях, окулированных в приклад на несколько лет раньше глазками с кустов, проявлявших симптомы одного только короткоузлия.
Распространение в естественных условиях. Хотя переносчик и не известен, но полевые наблюдения, проведенные в Калифорнии (Хыоитт, личное сообщение) и в Италии [195], показывают, что болезнь передается через почву. Нематода Xiphinema index найдена в почве Апулийских виноградников в Юго-восточной Италии, где болезнь распространяется, очевидно, естественным путем.
Меры борьбы. К моменту написания настоящей статьи не были известны результаты теплового лечения пораженных черенков.
Примечания. Наряду с короткоузлием, листовидные выросты встречаются иногда в сочетании с другими вирусными болезнями, например с ямчатостью древесины (legno riccio).
Обнаружение и идентификация. Болезнь можно обнаружить по проявлению симптомов (листовидные выросты на ранневесенних листьях нижних узлов) и идентифицировать путем передачи прививкой восприимчивым сортам винограда.
ЯМЧАТОСТЬ ДРЕВЕСИНЫ (LEGNO RICCIO)
Синонимы. Rugose wood; wood-pitting; stempitting.
История и географическое распространение. Болезнь была впервые отмечена в 1959 г. в Апулии, на ограниченном участке около Таранто [78, 147]; детальное описание симптомов было сделано позднее [146, 149].
Начиная с 1959т. болезнь была зарегистрирована во многих виноградниках Южной Италии, в Апулии и Лукании (Базиликата) и в Сардинии (Маррас, личное сообщение). Кусты, пораженные ямчатостью древесины, были обнаружены также в Израиле (Хыоитт, 1962, личное сообщение) и несколько позднее в Венгрии [195]. Эти данные можно расценивать как показатель относительной обычности этой болезни в Европе.
Экономическое значение. Потенциально болезнь имеет очень большое экономическое значение, хотя в настоящей статье оценить его трудно. По-видимому, степень ее вредоносности зависит от: 1) комбинации привоя и подвоя; 2) восприимчивости европейских сортов; 3) возможно, от вирулентности штаммов возбудителя. На самые восприимчивые прививочные Комбинации (Примитиве ди Джиойя: Vitis berlandieri X V. riparia 420 А; Москателло: У. rupestris ДюЛо) болезнь оказывает разрушительное действие, приводя к постепенному ослаблению и гибели растений. Ослабление всегда сопровождается прогрессирующим снижением урожая и в конечном счете полным бесплодием. Поэтому фермеры вынуждены удалять пораженные лозы, а в некоторых случаях выкорчевывать весь виноградник.
Круг растений-хозяев. На многих сортах V. uinifera (Кардинал, Италия, Регина, Праймас, Оганез, Примитиво ди Джиойя, Менна-вакка Пера, Москателло, Барезана, Разаки, Мускат Люнель, Перл оф Чаба, Итальянский Рислинг) симптомы болезни проявляются после прививки на многие американские подвои (V. berlandieri X XV. riparia 420 А, 157-11, 34Е, Тел едки 5А, Кобер 5В В; V. ripariaX X V.rupestris 3309; V. berlandieri X V. rupestris 17-37, 140; V. rupestris ДюЛо,)
Симптомы. а) Внешние симптомы. Пораженные растения низкорослые, и они менее мощные, чем нормальные. Весной почки на них распускаются на 4 - 5 недель позднее. В месте соединения глазка с подвоем образуется ясно выраженное вздутие при заметной разнице в относительной толщине стеблей подвоя и привоя; первый бывает обычно тоньше. Кора несколько грубее и более сильно опробковевшая, чем нормальная. Наряду с отмеченным выше снижением урожая, у больных лоз проявляется ряд деформаций листьев и побегов, неотличимых от тех, которые вызывают деформирующие штаммы вируса короткоузлия винограда.
Наиболее восприимчивые сорта (например, Примитиво ди Джиойя, привитый на V. berlandieri X V. riparia 420A) испытывают прогрессирующее ослабление и через несколько лет отмирают до места соединения прививки. В таких случаях подвой не погибает вместе с привоем, но после гибели верхушки развивает новые мощные побеги. В случае других прививочных комбинаций (Кардинал, Праймас, Регина на различных американских подвоях) подвои, по-видимому, не могут выживать после гибели привоя.
б) Макроскопические внутренние симптомы. На внутренней, обращенной к камбию стороне коры образуется ряд удлиненных выпячиваний шириной 1 - 6 мм и длиной 1 - 60 мм в форме ребер, гребней и зубцов. На центральном цилиндре появляются ямки и желобки глубиной 0,5 - 4 мм, соответствующие зубцам и ребрам прилегающей коры. Эти углубления расположены почти параллельно длинной оси стебля. Ямчатость древесины встречается в стеблях и корнях всех подвоев, тогда как присутствие или отсутствие ямчатости у привоев V. vinifera зависит от реакции сорта. Так, для сортов Оганез, Италия и Разаки характерна сильная ямчатость, а для сортов Кардинал, Праймас, Москателло и Березана - слабая. На сортах Регина, Примитиво ди Джиойя или Перл оф Чаба подобные симптомы вообще отсутствуют. Другой внутренний симптом - ненормальное утолщение коры - встречается обычно у подвоев. Но у некоторых комбинаций привоев и подвоев (Италия: 157-11, Праймас: 420А) наблюдается обратная картина: кора привоя оказывается значительно толще коры подвоя.
в) Микроскопические симптомы. Гистологическое исследование поперечных срезов через больные штамбы показывает, что мельчайшие ребра на коре состоят из гипертрофированных лучей, проникающих со стороны коры в функционирующую ксилему (рис. 120). Линия камбия имеет волнистые очертания, так что после удаления коры центральный цилиндр имеет неровно зазубренный контур. Ксилемные тяжи расположены нерегулярно и часто бывают расщеплены на 2 - 3 более мелких, которые тянутся в расходящихся направлениях, придавая центральному цилиндру бахромчатый вид. В ксилеме и во флоэме отмечен паренхиматоз (усиленное развитие паренхимы). В коре наблюдаются анатомические аномалии - гипертрофия, нарушения нормальной структуры и некроз флоэмы.
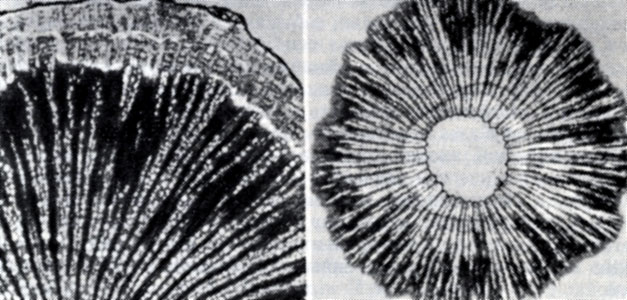
Рис. 120. Слева - поперечный срез через штамб подвоя Кобер 5ВВ. Обратите внимание на неправильный контур камбиального слоя, расщепление тяжей ксилемы и экстенсивный паренхиматоз древесины. Справа - поперечный срез через центральный (древесный) цилиндр подвоя Кобер 5ВВ. Обратите внимание на зазубренность его контуров и уменьшение сосудов ксилемы
Возбудитель. До сих пор не доказано присутствие в больных лозах каких-либо передающихся с соком вирусов, помимо вируса короткоузлия винограда. Наблюдения в поле и предварительные данные ведущихся исследований показывают, что вирус короткоузлия может играть главную роль в этиологии этой болезни.
Передача. Ямчатость древесины была передана прививкой здоровых привоев на пораженные подвои и наоборот; после инокуляции для появления диагностических симптомов (ямчатой древесины) должно пройти 2 - 3 года.
Распространение в естественных условиях. Полевые данные показывают, что болезнь передается через почву. В двух виноградниках, где наблюдалось распространение болезни, присутствовала нематода Xiphinema index.
Меры борьбы. Данные о результатах теплового лечения пораженных кустов отсутствуют.
Примечания. Ямчатость древесины можно рассматривать как болезнь прививочных комбинаций, поскольку привои или подвои могут передавать возбудителя, который не приносит заметного вреда им самим до тех пор, пока они развиваются раздельно. По-видимому, чтобы болезнь начала развиваться, необходим тесный контакт между обоими компонентами прививки. Таким образом, проявление симптомов на бессимптомном, хотя и системно зараженном подвое будет зависеть от его компонента (болезнь подвоя, зависящая от привоя).
Эта болезнь часто отмечалась в сочетании с другими известными вирусными болезнями (желтая мозаика, листовидные, выросты) и всегда присутствует на кустах сорта Разаки, пораженных некрозом побегов.
Обнаружение и идентификация. Инфекцию обнаруживают по проявляющимся симптомам (ямчатость древесины); болезнь можно идентифицировать путем передачи ее прививкой. Сильная реакция, наблюдаемая в полевых условиях на сортах Оганез и ДюЛо (Vitis rupestrls), показывает, что их можно использовать в качестве индикаторов.
НЕКРОЗ ПОБЕГОВ (SHOOT NECROSIS)
Синонимы. Necrosi del germogli.
История и географическое распространение. Болезнь отмечалась с 1963 г. в нескольких местностях Апулии (Юго-восточная Италия) и была описана в 1965 г. [197]. Она известна только в этой области, где встречается в пяти виноградниках общей площадью около 60 га. Происхождение этой болезни можно проследить вплоть до единственного куста, произрастающего во дворе одного из частных владений около Бари; этот куст служил маточным растением при закладке первого в Апулии промышленного виноградника сорта Разаки.
Экономическое значение. Потенциально оно очеяь велико, так как болезнь вызывает гибель многих молодых побегов и в конце концов может погубить целые кусты. Урожай снижается, хотя грозди обычно хорошо сформированы и какие-либо признаки заметного опадения или низкого качества ягод отсутствуют.
Круг растений-хозяев. Болезнь поражает только сорт Разаки (Vitis vinifera). По имеющимся данным, все произрастающие в Апулии лозы этого сорта поражены ею.
Симптомы. На базальной части нежных молодых побегов, достигших в длину 10 - 15 см, появляются мельчайшие буроватые пятна и углубленные бороздки. Эти поражения быстро разрастаются и сливаются, в результате чего значительная часть тканей коры быстро некротизируется. Некроз может сопровождаться продольным растрескиванием коры, что приводит к возникновению ряда относительно мелких удлиненных параллельных трещин, локализованных обычно на уровне узлов. Трещины могут возникнуть в результате разрыва некротизированных участков, пораженные ткани которых не способны следовать за ростом окружающей, нормально функционирующей паренхимы, или вследствие отщепления тех отмерших, корковых тканей, которые раньше отделялись от остальной части коры вследствие образования нескольких слоев опробко-вевших клеток. По-видимому, некоторые трещины возникают в результате поражений камбия, отражающихся на дифференцировании сосудистых тканей. В течение вегетации эти трещины заживают, но образовавшиеся на их месте рубцы бывают заметны на следующий год и придают побегам чешуйчатый и шероховатый вид. Базальные листья загнивающих побегов блекнут и увядают in situ, не опадая. Затем некроз распространяется на остальную часть побега, который через 1 - 2 недели засыхает. На рукавах лоз, у места отхождения побегов, часто встречаются ненормальные добавочные зачатки корней. Окраска листьев в начале сезона бывает бледной, но какие-либо аберрации окраски, за исключением диффузной мозаичной крапчатости, отсутствуют. Встречаются также различные уродства листьев и побегов, вызываемые деформирующими штаммами вируса короткоузлия. Древесина часто вызревает неравномерно.
Возбудитель. Имеются указания, что некроз побегов вызывается вирусом, но экспериментальные доказательства пока отсутствуют. Кроме вируса короткоузлия, ни один вирус, передающийся соком, не был выделен из зараженных растений. Взаимосвязь вируса короткоузлия с данной болезнью исследуется.
Передача. Синдром, наблюдаемый в поле, не удалось воспроизвести путем окулировки в приклад больной древесиной у свободных от вируса сортов Vitis vinifera (Кариньян, Бессемянный Томпсона и Мисьон) и Сент-Джордж (V. rupestus). Однако у этих растений обнаружено присутствие, по-видимому, вируса короткоузлия. Болезнь передается древесиной глазка.
Распространение в естественных условиях. Сведения отсутствуют.
Меры борьбы. Сведения отсутствуют.
Терапия. Результаты опытов по тепловой обработке и размножению верхушками побегов пока не известны.
Примечания. На всех пораженных растениях отмечались также яркие симптомы ямчатости древесины. Хотя в конечном счете может оказаться, что некроз побегов представляет собой особую реакцию сорта Разаки на эту болезнь, но, пока это не будет доказано экспериментально, некроз побегов следует считать отдельной болезнью.
Обнаружение и идентификация. Рано весной болезнь легко обнаружить по частой встречаемости некротизированных побегов. Подыскиваются соответствующие индикаторы.
ВЕРЕТЕНОВИДНОСТЬ ПОБЕГОВ СОРТА КОЛОМБАР (SPINDLE SHOOT OF COLOMBARD GRAPEVINE)
Синонимы. Отсутствуют.
История и географическое распространение. Веретеновидность побегов впервые была обнаружена весной 1950 г. в винограднике сорта Коломбар в долине Напа (Калифорния). Затем она была найдена еще в двух виноградниках того же сорта, также в долине Напа.
Экономическое значение. Значение ее не известно, за исключением того, что болезнь может распространяться черенками и древесиной привоев, используемых при окулировке или прививке.
Круг растений-хозяев. Болезнь обнаружена только на сорте Коломбар. Сходные, но несколько отличающиеся болезни, наблюдались на сортах Сальвадор и Тинта Мадейра.

Рис. 121. Симптомы веретеновидности побега на кусте винограда сорта Коломбар
Симптомы. Болезнь характеризуется быстрым удлинением побегов и мелкими, недоразвитыми листьями. Фактически побеги не имеют веретеновидной формы; по длине и диаметру они не отличаются от побегов на нормальных кустах (рис. 121). Но длинные побеги с мелкими листьями создают впечатление "веретеновидности". Листья достигают всего лишь 1/4 - 1/2 нормального размера. Края листьев хлоротичны, и рост их ограничен, тогда как центральная зеленая часть пластинки отличается пестротой и сморщиванием ткани вдоль крупных жилок. Листья имеют разнообразную чашевидную форму и скручены (рис. 121). Соцветия мельче нормальных.
В течение вегетационного периода рост листьев постепенно выравнивается и становится нормальным. К середине сезона обычно трудно отличить больные кусты от внешне здоровых по общей морфологии.
Интенсивность проявления симптомов варьирует в зависимости от года. В средние годы симптомы выражены слабо, и отличить больные кусты можно только рано весной. Но в некоторые годы симптомы проявляются очень резко, и контраст с нормальными лозами бросается в глаза.
Возбудитель. Окончательно не определен.
Передача. Не удалось передать болезнь от больных лоз сорта Коломбар путем окулировки в приклад здоровым, находившимся под наблюдением в течение четырех сезонов. Однако ее распространение можно было проследить от виноградника к винограднику в течение трех последовательных циклов вегетативного размножения. Имеются указания, что основная причина имеет генетическое происхождение и, возможно, заключается в изменчивости глазков.
Распространение. Болезнь может распространяться при размножении винограда глазками или черенками с пораженных кустов.
Меры борьбы. Следует избегать размножения материалом с пораженных кустов.
НЕКОТОРЫЕ ДАННЫЕ О ВЛИЯНИИ ЭКЗОГЕННЫХ РЕГУЛЯТОРОВ РОСТА РАСТЕНИЙ И ГЕРБИЦИДОВ НА ВИНОГРАД
Регуляторы роста растений представляют собой отличные от элементов питания органические соединения, которые в небольших количествах ускоряют, тормозят или иным образом модифицируют любой физиологический процесс в растениях [212]. Питательные вещества определяются здесь как соединения, доставляющие энергию или необходимые элементы питания. Растительные гормоны представляют собой регуляторы, вырабатываемые самими растениями, и в низких концентрациях регулируют физиологические процессы в них. Обычно они перемещаются внутри растения от места их образования к месту действия.
Термин "регулятор" имеет очень широкое значение, поскольку его можно отнести к материалу, который модифицирует любой физиологический процесс в растении. В тех случаях, когда речь идет о сельскохозяйственных химикатах, используемых для воздействия на урожай, его следует применять вместо термина "гормон". Строго говоря, термин "гормон" нужно относить только к естественно встречающимся растительным продуктам. Однако слово "регулятор" не обязательно относить только к синтетическим соединениям, так как это понятие может включать и гормоны.
Имеется четыре основных класса регуляторов роста растений: ауксины, гиббереллины, кинины и ингибиторы, которые естественно встречаются в растениях, в том числе в винограде, и регулируют их рост. Но если гормоны или синтетические регуляторы роста применяются на растениях в избыточных количествах, их нормальное стимулирующее действие нарушается и возникают ненормальности роста. При одних обстоятельствах стимулирующее действие их на - рост и развитие растений усиливается, при других - рост задерживается. В любом случае возможны аномалии роста растений.
Гормоны могут участвовать во многих общих изменениях, вызываемых вирусными инфекциями. Вирусы могут косвенно воздействовать на растения, влияя на естественный баланс гормонов [26, 45]. Это обстоятельство может быть причиной того, что избыток некоторых гормонов или регуляторов роста в растениях вызывает образование симптомов, сходных с симптомами вирусных болезней. В силу отсутствия более подробных данных о действии гормонов этот аспект вирусных болезней заслуживает более подробного изучения. В настоящей статье разбираются те симптомы, вызываемые у винограда избытком регуляторов роста, которые можно смешать с симптомами вирусных болезней.
Избыток ауксинов. Ауксины можно определить как гормоны, которые стимулируют растяжение клеток в стеблях молодых злаков или колеоптилях. Специфический тест на ауксины заключается в том, что они вызывают изгиб колеоптиля Avena.
Начиная с 1946 г. 2,4-Д (2,4-дихлорфеноксиуксусная кислота) и близкие ауксины широко использовались в качестве гербицидов. Эти соединения представляют собой избирательные гербициды в том смысле, что широколистные растения очень чувствительны к их действию, но злаки почти совершенно нечувствительны. Это обстоятельство обусловило непосредственное применение их в посевах зерновых для уничтожения горчицы, осота и других двудольных растений. Были созданы и другие соединения, которые оказывали лишь слабое действие на широколистные культуры, но убивали широколистные сорняки в посевах. С самого начала было отмечено, что при использовании этих соединений, особенно при опрыскивании с самолетов, наблюдался значительный снос препаратов, часто приводивший к повреждению соседних посевов чувствительных культур.
Виноград относится к числу наиболее чувствительных культурных растений. Имеются сообщения, что в результате сноса повреждались растения на участках, отстоявших на 64 км и больше от места проведения обработки. Снос, хотя и менее сильный, наблюдается и при наземных обработках. Симптомы избытка ауксина, нередко напоминающие симптомы вирусных болезней, часто наблюдаются в виноградниках. Обработка почвы ауксиноподобными гербицидами иногда вызывает на лозах типичные симптомы. Во многих виноградниках мира на отдельных листьях можно обнаружить повреждения типа вызываемых 2,4-Д, независимо от того, известно здесь было о применении 2,4-Д или нет. Причина заключается в том, что мельчайшие количества 2,4-Д и близких соединений могут вызывать деформации листьев.

Рис. 122. Листья сорта Токай, взятые с побега через две недели после опрыскивания куста до цветения 2,4-Д в концентрации 8 мг/л. Вверху слева - контрольный (нормальный) лист. Степень повреждения листьев варьирует от слабого проявления формообразующего действия до отсутствия способности к распусканию и появления листьев ремневидной формы. Некоторые повреждения сходны с симптомами короткоузлия. Обратите внимание на посветление жилок, сильную зубчатость (изрезанность) пластинок и уплощенность нижних частей листьев
Действие 2,4-Д на листья и штамбы. Если куст винограда с молодыми побегами обработать 2,4-Д в высокой концентрации, то через 2 ч после обработки на нем могут появиться эпи-настические искривления (загибание листьев книзу и изгибание побегов и усов). Листья и стебли постепенно желтеют и через шесть недель обычно отмирают. Весь куст целиком не погибает; позднее развиваются мощные волчки.
При более низких концентрациях эпинастические реакции проявляются слабее, хотя верхушечная часть побега нередко буреет и отмирает. Нередко наблюдается образование каллюса и растрескивание лоз, побегов и сучков. Ауксины часто стимулируют образование каллюса (масса недифференцированной меристематической ткани), из которого отходят корнеобразные выросты при содержании во влажной атмосфере. При опрыскивании винограда относительно низкими концентрациями 2,4-Д, т. е. в количествах, сходных с создающимися в результате сноса препарата, эпинастия может отсутствовать. На нормально развитых листьях формообразующее действие (ненормальное жилкование листьев и т. д.) не проявляется, но на молодых листьях по мере их созревания возникают деформации [28].
Высокие концентрации 2,4-Д вызывают сморщивание взрослых листьев, но только у вновь образовавшихся с ненормальным жилкованием. Степень повреждения различных листьев зависит от стадии их развития в момент обработки (рис. 122). В точке роста имеется обычно 7 или 8 неразвившихся листьев, а у основания верхушки 3 или 4 распускающихся листа. Наиболее явные симптомы проявляются на самых молодых из этих листьев, которые имеют ремневидную форму и сильно отстают в росте. Быстрее реагируют на воздействие ауксина молодые меристематические ткани. Наименее сильно поврежденные листья отличаются лишь слабыми аномалиями жилкования или легкой морщинистостью.
Чувствительность лозы к действию 2,4-Д. Виноград весьма чувствителен к действию 2,4-Д. Опыты показали, что если нанести каплю, содержащую 0,1 мкг 2,4-Д, на точку роста побега сорта Токаи длиной 2,5 - 5 см, она оказывает деформирующее действие на развивающиеся листья [337]. Мы показали, что капля содержащаяся 0,0001 мкг 2,4-Д, при помещении на молодой лист сорта 1окаи окажет позднее формообразующее действие (рис 123) Следовательно, соответствующее размещение 0,8 мг 24-Д может вызвать деформацию листьев на каждом кусте в виноградниках сорта Токаи на площади 8000 га близ Лоди (Калифорния). Такой же чувствительностью обладает сорт Конкорд [82], По мере роста побегов для проявления формообразующего действия требуются большие количества 2,4-Д.

Рис. 123. Взрослые листья сорта Токай, на которые в период их поста было нанесено по капле, содержавшей 0,0001 мкг 2,4-Д. Обратите внимание на сморщивание и ненормальное жилкование листьев и на ограниченность области повреждения листа. Такие симптомы можно обычно наблюдать в виноградниках всего мира
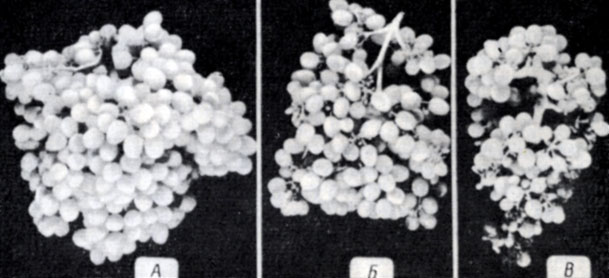
Рис. 124. Грозди сорта Бессемянный Томпсона через 96 дней после погружения их во время полного цветения в раствор 2,4-Д в концентрациях: нулевой (Л), 5 мг/л (Б) и 25 мг/л (В), Обратите внимание на присутствие дробевидных мелких ягод в двух последних вариантах. Симптомы сходны с симптомами короткоузлия или пожелтения жилок. При концентрации 50 мг/л повреждения (на фотографии не показаны) заметно усиливаются и приводят к гибели гроздей
Если обрабатывают верхушку побега, то для того чтобы 2 4-Д достигла чувствительной точки роста, не требуется перемещения ее в растениях. Но если обработке подвергаются более старые листья, то для проявления формообразующего действия нужно, чтобы это соединение переместилось из листа в верхушку побега или в молодые боковые почки и побеги. В этом случае для проявления действия требуются большие количества 2,4-Д. В одном из опытов капли, содержащие от 0,00001 до 600 мкг 2,4-Д наносили на основание верхней поверхности листовых пластинок на молодых побегах сорта Токай длиной 4 - 6,5 см [335]. Обработке подвергали четвертый или пятый листья от основания побега. Через две недели после применения 2,4-Д в дозировке от 1 до 600 мкг возникали аномалии жилкования листьев на апикальных 15 см побегов. В других опытах, проведенных на сорте Токай, капли, содержащие 2,4-Д, наносили на основания листьев у оснований побегов, достигших длины 30 - 45 см [337]. Для повреждения побегов требовалось около 10 мкг 2,4-Д.
Действие на плоды. 2,4-Д, попавшая в виноградник в результате сноса, может оказать самое различное действие - от полного отсутствия повреждений до сплошного побурения и отмирания гроздей. Молодые грозди значительно более чувствительны, чем зрелые. Средние дозы 2,4-Д вызывают появление множества мелких дробевидных ягод и снижают размер нормальных ягод (рис. 124). Нередко наблюдается искривление оси грозди, ее боковых веточек и усов. После цветения и завязывания плодов действие 2,4-Д сказывается обычно слабо. Однако подобные обработки задерживают окрашивание и созревание ягод.
Влияние 2,4-Д на вызревание побегов. Во многих виноградниках, поврежденных 2,4-Д, апикальная половина или треть побега несет только мелкие, аномальные листья. Это снижает общую фотосинтетическую активность и может помешать созреванию древесины. Иногда эти побеги содержат меньше усвояемых углеводов (Сахаров и крахмала), чем необработанные. На поврежденных побегах часто образуются каллюсы и трещины.
Изучалось влияние сноса 2,4-Д в виноградники на развитие побегов, отложение запасных углеводов и плодоношение. Если сносы 2,4-Д происходят в начале вегетационного периода и снижают урожай, но не губят побеги, то кусты быстро оправляются. В год после сильного ранневесеннего повреждения продуктивность сортов V. vinifera (Коломбар, Паломино и Вальдепеньяс) в одном из виноградников на побережье Калифорнии составила около 86% нормального урожая [337].
Проникновение 2,4-Д в виноградный куст. В течение вегетационного периода 2,4-Д проникает в лозы главным образом через листья. После поглощения его растением это соединение передвигается вместе с током выработанных в листе питательных веществ в другие части куста в направлении оттока продуктов фотосинтеза. 2,4-Д может проникать в кусты также через поражения или срезы побегов после обрезки - основной способ проникновения в период зимнего покоя [334]. Большое количество 2,4-Д проникает в плодовые побеги, если опрыскивание проводят вскоре после обрезки. Однако через 2 - 3 недели срезы затягиваются, и дополнительные количества 2,4-Д уже не могут проникать в растения. В общем, если 2,4-Д попадает в виноградник в период зимнего покоя, то на листьях никаких симптомов не образуется, за исключением тех случаев, когда обработку проводят вскоре после обрезки.
Сравнительные опыты по определению количеств 2,4-Д, поступающих в растение через обрезанный побег, спящую почку или через междоузлие, показали, что наибольшие количества проникают в куст через поранения, остающиеся после обрезки, а наименьшие - через междоузлия. Некоторое количество 2,4-Д проникает, очевидно, сквозь трещины в почках. В период зимнего покоя почву и основания штамбов опрыснули высокими дозами 2,4-Д (до 140 кг/га), но в результате этого симптомы на листьях были выражены очень слабо или совсем отсутствовали [334]. Во влажной почве 2,4-Д быстро разлагается.
Перемещение. В очень молодых стеблях ауксины передвигаются в полярном направлении, от верхушки к основанию. Это характерное свойство ауксинов. Но в более зрелых побегах и кустах ауксины передвигаются по флоэме с током продуктов фотосинтеза. Сахара вырабатываются в листьях и из этого источника передвигаются к развивающимся плодам, верхушкам побегов, пазушным почкам, побегам, камбию и т. д. Установлено, что отток углеводов из листьев начинается, когда последние достигают половины своей нормальной величины [150]. По-видимому, 2,4-Д передвигается в кустах винограда менее быстро, чем углеводы. Например, при двухрукавной системе формирования куста один рукав можно опрыснуть 2,4-Д и практически убить его, тогда как другой совершенно не пострадает. Возможно также, что применение 2,4-Д превращает обработанный рукав в место стока, куда ассимиляты только вносятся без выноса 2,4-Д [133]. Если 2,4-Д проникает в куст через повреждения или срезы побегов, она может перемещаться вверх по ксилеме и переноситься с транспирационным током.
Действие 2,4-Д на стадии развития виноградной лозы. Повреждение побегов и гроздей бывает наиболее сильным в тех случаях, когда 2,4-Д сносится на лозы в период, когда побеги молодые и сочные. Наиболее сильно реагируют на ауксины молодые меристематические ткани. С возрастом побеги становятся менее чувствительными к 2,4-Д. Опрыскивание кустов сорта Токай 2,4-Д в концентрации 2 или 8 мг/л на пяти различных стадиях развития показало, что наиболее сильная деформация листьев наблюдалась при обработке куста на второй (длина побегов достигает примерно 30 см) и третьей (цветение или опадение лепестков) стадиях развития. Те же обработки вызывали и наиболее сильные повреждения плодов, определяемые по весу урожая, весу гроздей и количеству дробевидных ягод. Второе опрыскивание обычно сильнее повреждало грозди, чем третье. Интенсивность повреждений, вызываемых 2,4-Д, варьирует от года к году в силу изменчивости климатических условий в разные сезоны. Дождь, прошедший после применения 2,4-Д, может ослабить ее вредное действие, особенно на урожай.
Лозы сорта Токай, опрыснутые 2,4-Д в концентрации 200 или 2000 мг/л до цветения, во время цветения или в фазе завязывания плодов, теряли листья, хотя и образовывали волчки. Обработка в период цветения оказывала более сильное токсическое действие, чем обработка до цветения. Опрыскивание 2,4-Д в фазе завязывания плодов в концентрации 20 мг/л вызывало лишь слабые повреждения листьев. Гроздья, опрыснутые 2,4-Д в концентрации 200 или 2000 мг/л до цветения или во время него, погибали; концентрация 20 мг/л снижала вес гроздей, частично из-за прекращения роста ягод.
Переход симптомов, вызванных 2,4-Д, из года в год. Формообразующее действие 2,4-Д, оказываемое ею в виноградниках рано весной, обычно не проявляется в следующем вегетационном периоде. И даже если лозы из года в год подвергаются действию 2,4-Д, кумулятивный вредный эффект отсутствует, если только не уменьшится фотосинтезирующая поверхность. Действие, оказываемое ранневесенним опрыскиванием 2,4-Д, сохраняется и часто оказывает формообразующее действие на листья, которые развиваются позднее. Применение 2,4-Д на кустах сорта Токай в период покоя через две недели после обрезки вызывало деформации листьев в следующем вегетационном периоде.
Если кусты опрыскивают 2,4-Д или близкими соединениями в конце вегетационного периода, обнаружить формообразующее действие ее бывает трудно, так как побеги растут в это время чрезвычайно медленно. Но при использовании высоких концентраций (10 - 50 мг/л) симптомы могут проявиться в следующем году вегетации. Если куст опрыскивают в конце вегетационного периода, 2,4-Д перемещается в древесину и, возможно, в корни. В следующем году ток запасных веществ и 2,4-Д сравнительно рано начинает передвигаться кверху в побеги, и на листьях проявляется формообразующее действие ауксина. Но такие высокие дозы 2,4-Д относительно редко применяются в конце сезона.
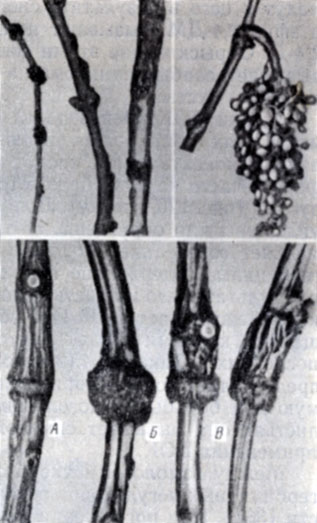
Рис. 125. Вверху - части побегов с кустов сорта Бессемянный Томпсона, опрыснутые 4-ХФК в концентрации 40 мг/л. Обратите внимание на трещины и вздутия на побегах, следы опробкования коры и остановившиеся в росте ягоды с утолщенными плодоножками. Внизу - части побегов с кустов сорта Бессемянный Томпсона примерно через 4 месяца после кольцевания: А - побег с неопрыснутого (контрольного) куста; Б и В - с кустов, опрыснутых 4-ХФК в концентрации 10 и 20 мг/л. На опрыснутых кустах образуются многочисленные каллюсы, а побеги над кольцом бывают толще, чем под ним (В). Симптомы напоминают корончатый галл, вызываемый бактериальной инфекцией
Действие других ауксинов, кроме 2,4-Д. Другие ауксины ряда феноксиуксусной кислоты вызывают появление на листьях винограда симптомов, сходных с теми, которые вызывают 2,4-Д, но токсичность их сильно различается. 4-ХФК (4-хлорфенок-сиуксусная кислота) применялась в виноградниках сортов Бессемянный Томпсона и Коринка черная для увеличения размера ягод. Если обработку кустов проводили в соответствии с рекомендуемыми дозировками, то лишь на небольшом числе побегов появлялись аномальные листья. Эти немногие листья не приносили вреда растениям. Но если применяются слишком высокие дозы 4-ХФК, рост листьев сильно задерживается, побеги и рукава растрескиваются, образуются галлы, напоминающие каллюсы, и рост ягод замедляется (рис. 125, вверху). Встречаются также остановившиеся в росте ягоды с утолщенными плодоножками. В тех случаях, когда 4-ХФК используется в дополнение к кольцеванию, на окольцованной части побега могут образоваться крупные каллюсы (рис. 125, внизу).
Соединения 2,4-ДМ (2,4-дихлорфеноксимасляная кислота) и эфир 2,4-ДМ используются обычно как гербициды в посевах клевера. Эти вещества также могут повредить виноградники, если попадут в него в результате сноса. На кустах сорта Токай 2,4-ДМ и эфир 2,4-ДМ вызывают примерно такие же повреждения, как 2,4-Д. Опрыскивание этими соединениями в концентрации 0,1 мг/л вызывает слабые симптомы, а в концентрации 3 мг/л сильно повреждает кусты.
Ауксин БОК (бензо.иазол-2-оксиуксусная кислота)* вызывает на листьях симптомы, отличающиеся от вызываемых соединениями ряда феноксиуксусной кислоты [333]. Листья имеют чашевидную форму, часто на них образуются удлиненные выросты на кончиках зубцов (рис. 126, вверху). Лопасти некоторых листьев часто бывают уплощены или округлены. Это соединение чрезвычайно сильно замедляет созревание плодов. В виноградниках часто используются гербициды, содержащие полихлорированные бензойные кислоты, в результате чего на листьях появляются симптомы, сходные с теми, которые вызывает БОК. При обработке почвы эти гербициды поглощаются корнями и переносятся в листья, вызывая деформации последних. Дикамба (2-метокси-3,6-дихлорбензойная кислота)* представляет собой хлорированную бензойную кислоту, применяемую для борьбы с многолетними сорняками в виноградниках. На листьях она вызывает симптомы, сходные с появляющимися при применении БОК.
*(В СССР не применяется. - Ред.)
Между гомологами уксусной и пропионовой кислот некоторых гербицидных регуляторов роста наблюдаются различия в токсичности [337]. При погружении апикальных участков (15 см) 30-сантиметровых побегов сорта Токай в растворы, содержащие 2,4-Д, 2,4-ДП (2,4-дихлорфеноксипропионовая кислота), 2,4,5-Т (2,4,5-трихлорфеноксиуксусная кислота)*, 2,4,5-ТП (2,4,5-трихлорфенокси-пропионовая кислота)*, 4-ХФК или 4-ХФП (4-хлорфеноксипропио-ыовая кислота)* различной концентрации (от 0,00001 до 100 мг/л), гомологи пропионовой кислоты 2,4-Д и 2,4,5-Т были более токсичны, чем гомологи уксусной кислоты, тогда как для 4-ХФП наблюдалась обратная картина.
*(В СССР не применяется. - Ред. )
2,4,5-Т была более токсична, чем 2,4,-Д, а наименее токсичной оказалась 4-ХФК. Однако если кусты сорта Мускат Александрийский опрыскивали 2,4-Д, 2,4-ДП, 2,4,5-Т, 2,4,5-ТП, 4-ХФК и 4ХФП в концентрациях 0,5, 20 или 50 мг/л, то 2,4-ДП была несколько менее токсична, чем 2,4-Д, т. е. результаты оказались обратными тем, которые получились в опытах с погружением побегов. 2,4,5-Т была более токсична, чем 2,4-Д, а 4-ХФК вызывала более сильные повреждения, чем 4-ХФП. В опытах с более высокими концентрациями тех же соединений (от 100 до 300 мг/л) токсичность 2,4-Д и 2,4,5-Т была примерно одинакова, а 2,4-Д - немного более токсична, чем 2,4-ДП. Нафтилуксусная кислота использовалась для прореживания гроздей в период цветения. Она прореживает плоды, вызывая образование мелких дробевидных ягод (рис. 126, внизу).

Рис. 126. Вверху - нормальные листья; ниже - чашевидно искривленные и недоразвитые листья сорта Рибье после опрыскивания БОК в концентрации цветения 20 мг/л. Внизу - грозди сорта Цинфандель после опрыскивания во время цветениянафтилуксусной кислотой в концентрациях 0 (А), 100 (Б) и 500 мг/л (В). Б - нормальная степень прореживания; В чрезмерно сильное прореживание, сопровождающееся плохим завязыванием ягод и образованием мелких дробевидных ягод, что предполагает присутствие вирусов короткоузлия и пожелтения жилок присутствие вирусов короткоузлия и пожелтения жилок.
Гиббереллины. Гиббереллины - регуляторы роста растений. Они стимулируют рост некоторых карликовых мутантных растений. Гиббереллины обычно заметно увеличивают длину междоузлий и стеблей [335]. Начиная с конца 1950-х годов гиббереллины применялись в виноградниках в промышленном масштабе. Опрыскивание кустов гиббереллинами, особенно в период, когда длина побегов достигала всего 35 - 50 см или меньше, стимулировало быстрое удлинение побегов и их утолщение, а листья желтели примерно на 10 дней (рис. 127, слева). На лозах, опрыснутых гиббереллинами, листья часто бывают уплощены у основания и сильно напоминают листья, зараженные вирусом короткоузлия (рис. 127, в центре и справа). На листьях сорта Бессемянный Томпсона, опрыснутых гиббереллином на расстоянии около 7 мм от главных жилок и параллельно им, появляются светлые участки. При более внимательном рассмотрении видно, что эти светлые полосы состоят из коротких, нерегулярно расположенных линий.
Гиббереллины широко используются для увеличения размера ягод Бессемянный Томпсона и Коринка черная, а также на некоторых винных сортах. Опрыскивание гиббереллином до цветения вызывает удлинение и разрыхление гроздей винных сортов винограда с плотной кистью (рис. 128). Образуется также некоторое количество мелких, дробевидных ягод [335]. При слишком высоких концентрациях гиббереллина у семенных сортов в следующем году подавляется развитие почек. Распускание почек задерживается, и образуется меньшее число гроздей. Эти симптомы можно спутать с симптомами скручивания листьев винограда. Для бессемянных сортов винограда гиббереллины не токсичны. У сортов, образующих семена, кусты дают очень различные реакции на гиббереллины.

Рис. 127. Слева - куст сорта Цинфандель через 9 дней после опрыскивания гиббереллином в концентрации 50 мг/л. Обратите внимание на удлиненные побеги и кисти и бледную окраску листьев. Справа - лист с куста сорта Цинфандель, опрыснутого до цветения гиббереллином в концентрации 10 мг/л. В центре контрольный (нормальный) лист. Обратите внимание, что опрыснутый гиббереллином лист имеет такое же выравненное основание, как лист, пораженный короткоузлием

Рис. 128. Грозди сорта Цинфандель, обработанные перед цветением гиббереллином в концентрации 0 (А), 10 (Ј), 100 (В) и 1000 мг/л (Г) Образование дробевидных мелких ягод сходно с тем, которое наблюдается при поражении винограда пожелтением жилок, но удлиненные плодоножки свидетельствуют о реакции на гиббереллин
Кинины. Кинины - регуляторы роста, вызывающие деление клеток у растений. Кинины бензиладенин и близкие соединения усиливали завязывание бессемянных ягод на гроздьях и увеличивали размер ягод у сорта Коринка черная [336]. Мускат Александрийский реагирует на кинин образованием более высокого процента мелких, дробевидных ягод.
Ингибиторы. Ингибиторы - регуляторы роста, подавляющие или задерживающие физиологический или биохимический процесс в растениях. За последние годы создано несколько синтетических ингибиторов. Ингибиторы роста растений замедляют деление и растяжение клеток в тканях побегов, и физиологически регулируют высоту растений без формообразующего эффекта [58]. Из этих соединений лучше других изучены ССС (2-хлорэтилтриметилхлорид аммония), В995 (N-диметил-аминоянтарная кислота), АМО-1618 (4-гидрокси-5-изопропил-2-метилфенилтриметил-хлорид аммония, 1-гиперидинкарбоксидат) и фосфон (2,4-дихлорбензилтрибутил-фосфохлорид). ССС и В995 задерживают рост побегов, оказывая действие, противоположное реакции, вызываемой либбереллинами. ССС вызывает хлороз листьев винограда. В результате обработки кустов ССС и фосфоном не менее чем за три недели до цветения у сортов Коринка черная и Мускат Александрийский увеличивается число ягод с семенами [83].

Рис. 129. Вверху - нормальный неповрежденный лист. Внизу - листья винограда сорта Рубиред, поврежденные в результате опрыскивания симазином. Листья, обработанные симазином, имеют хлоротичный вид, но зеленые участки вдоль жилок отличают эти симптомы от симптомов поражения вирусом желтой мозаики
Действие гербицидов. В виноградниках применяются некоторые гербициды, не являющиеся регуляторами роста. Симазин [2-хлор-4,6-бис (зтиламино) -5-триазин] временно стерилизует почву и может вызвать у винограда пожелтение краев листьев, которое в случае более сильного повреждения распространяется на участки между жилками (рис. 129). Эти повреждения сходны с симптомами поражения винограда вирусами окаймления и пожелтения жилок. Диурон [3- (3,4-дихлорфенил) - 1,1 -диметилмочевина] представляет собой замещенную мочевину; он временно стерилизует почву и применяется для борьбы с сорняками в винограднике. Он вызывает пожелтение жилок. Другой препарат замещенной мочевины, применявшийся прежде в виноградниках Калифорнии, - монурон [3-(р-хлорфенил)-1,1-диметилмочевина] стерилизует почву и вызывает межжилковое пожелтение.
ХИМЕРЫ И СХОДНЫЕ ОБРАЗОВАНИЯ
У винограда, как и у любой вегетативно размножаемой культуры, химеры представляют, вероятно, обычное явление. Химеры возникают в результате мутаций (в широком смысле: генных, хромосомных, соматических перекомбинаций и т. д.) в клетке верхушечной меристемы. Согласно теории Дермена [92, 93], измененная зона охватывает только часть одного из двух онтогенетических слоев клеток, существование которых у винограда показали Томпсон и Олмо [282]. В этом случае образуется так называемая мериклинальная химера.
Мутация может выжить лишь в том случае, если происшедшая от нее клеточная линия способна успешно конкурировать с окружающими (нормальными) линиями клеток.
Мутировавшая клеточная линия в конце концов займет весь слой, в котором она развивается, при условии, что верхушечная меристема полностью дифференцирована в пределах мутировавшего сектора: побег, развивающийся из этой меристемы, и любой отходящий от него побег состоит в этом случае из двух гомогенных, но генетически различных онтогенетических слоев. При этом положении развивается периклинальная химера.
Эти два типа химер можно обнаружить сразу же при условии, что: 1) изменение достаточно хорошо заметно (или исследование проведено достаточно тщательно) и 2) изменен именно наружный слой, поскольку только он определяет фенотип растения.
Если мутировал внутренний слой, химера будет обнаружена вследствие процесса реверсии (перераспределения слоев в результате восстановления точки роста с иным расположением слоев). Реверсии встречаются в природе, но их можно вызвать также облучением [102, 245] или сильной обрезкой [239].
Возникновение мелких мутаций может происходить с относительно высокой частотой в силу множественности хромосомальных сайтов, множественности онтогенетических центров (верхушек побегов), являющихся участками их возникновения, и наконец их слабого действия, позволяющего им выжить в условиях конкуренции.
Накопление мелких мутаций ведет к полихимерной структуре клопового сорта, что в комбинации с действием естественной реверсии создает внутрисортовую изменчивость, которая усиливается с течением времени. Эта изменчивость может объяснить по крайней мере частично успех клопового отбора.
Составить исчерпывающий список известных химер невозможно из-за обширной литературы, накопившейся почти за 100 лет, и отсутствия достаточной точности в большинстве описаний. Поэтому мы ограничимся классификацией наблюдаемых типов химер (химерных ситуаций).
1. "Вечномутирующие" химеры. Сюда относятся стабильные секториальные химеры, химерная структура которых проявляется большую часть времени в окраске ягод, связанной с осенним потемнением листвы. Примерами служат: Трессо пестрый (Tressot panache) [Viala and Vermorel, 1902; (табл. З, стр. 306)] и мутант Бекиньоля (Bequignol mutant) (в ампелографической коллекции научно-исследовательской станции виноградарства). Смотрите рисунок 50 на странице 145.
2. Химеры, возникающие в результате периодических реверсий. Этот тип химер встречается относительно часто у старых сортов. Их появление часто описывается как "мутация", но их периодичность служит убедительным доказательством существования в пределах сорта клонов, у которых внутренний слой генетически отличается от наружного. Многие из них представляют собой, вероятно, мутации, которые закрепились и широко используются. Примеры: Ugni Blanc - появление в нескольких местах розовых мутаций (Ривс, неопубликованные данные); Гролло Гри (Grolleau Gris) - мутация, затрагивающая внешний слой у растений сорта Гролло Сент-Марк (Grolleau de Saint-Marc) и очень часто возвращающаяся к исходному типу в результате развития глубоко заложенных спящих почек [239] под воздействием сильной обрезки.
Известно также и несколько других "серых" сортов, которые с определенной частотой возвращаются к белому или красному типу, например Пино Гри, Арамон Гри и Гренаш Гри. Большинство из них недавно получило распространение в культуре, причем известно, что они возникли в результате мутаций.
3. Химерные состояния, предположительно возникшие в результате клопового отбора. Экспериментально примеры таких положений не доказаны. Об их существовании заключают на основании известных фактов [241] и успехов клоновой селекции, достигаемых после удаления той части изменчивости, которая обусловлена вирусными болезнями, передающимися через прививку.
4. Генетически контролируемые химеры. В половых поколениях встречается несколько типов частичных дефектов хлорофилла с простым генетическим контролем. Если эти химеры не летальны, они могут или исчезнуть с ростом растения, или сохраниться. В поколениях от самоопыления некоторых сортов регулярно присутствует один из типов устойчивой мраморной пестро-листности. Р. Галзи и П. Галзи [126] исследовали его поведение у самоопыленных сеянцев сорта Арамон. На долю белой ткани, по-видимому, влияет температура, так как при высоких температурах белые ткани исчезают. Такое же происхождение может иметь пестролистность, характерная для Муската Гамбургского. То же относится и к Султанина Марбре - "отцовской" форме сорта Перлетт.
У гибридов Vitis rotundifolia X Euvitis часто встречаются хлорофильные пестролистности с различными оттенками зеленого цвета (Барретт, личное сообщение). Они могут быть вызваны хромосомной нестабильностью, обусловленной природой межвидовых гибридов.
Методы обнаружения периклинальных химер. Гаметы образуются исключительно из внутреннего слоя. Таким образом, если внутренний слой химер мутировал по генетически простому признаку, расщепление при самоопылении может быть совершенно иным, чем ожидается; например, в потомстве растения, несущего белые ягоды, но имеющего красный внутренний слой, отношение красных ягод к белым будем составлять 3:1.
Возможно, этот тест можно использовать также для демонстрации генетического разнообразия среди клонов одного и того же сорта, применив дифференциальный анализ для различения их потомства по способу, предложенному Вагнером [332].
Для выявления химерной природы сортов гвоздики и груш применялось облучение. Мы испробовали возможность его применения в отношении винограда. По данным Сагавы и Мелквиста [245], облучение разрушает меристематические клетки наружного слоя точки роста. Вслед за этим из выживших клеток формируется новая точка роста. Клетки из внутреннего слоя имеют больше шансов на выживание, поэтому новая меристема часто будет целиком состоять из клеток, происходящих из внутреннего слоя. Вследствие этого получающийся побег гомогенен по генетической структуре с внутренним слоем и обладает соответствующим фенотипом.
Химеры нужно отличать от вирусных болезней и от влияния физиологической избыточности (carry-over effects). Микроскопические различия, например изменение окраски ягод или мутации опушения, нельзя смешать с симптомами какого-либо из указанных явлений. Но успехи клоновой селекции в отборе лучших клонов, которые в общем фенотипически неотличимы от остальной популяции, привели ученых к убеждению, что объяснить эти различия можно присутствием неизвестных или "латентных" вирусов.
Соответствующий тест состоит, очевидно, в проведении перекрестных прививок между различными клонами и в наблюдениях за передачей указанных различий прививкой.
О эффектах физиологической избыточности сообщает Биоллетти [24]. В его опыте влияние мощности материнских лоз передавалось их потомству, но после нескольких лет исчезало. Этот эффект может объяснить некоторые различия, которые Вудхем и Александер [345] обнаружили в потомстве своих лоз сорта Султана. Первые результаты проведенного нами опыта по сравнению потомков лоз одного клона, высаженных в различных местах, показали очень сильное влияние "происхождения" на урожай ягод в первый год уборки. Через некоторое время эти эффекты исчезают, так же как они исчезали в винограднике Биолетти.
В заключение следует подчеркнуть, что вегетативное размножение создает любые возможности накопления у клоповых сортов любого типа изменений.
Поскольку селекционер в первую очередь заинтересован в использовании преимуществ наследственной изменчивости, создаваемой мутациями для отбора лучших клонов, он должен тщательно контролировать все эффекты физиологической избыточности и не смешивать их с вирусами.
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://wine.historic.ru/ 'Виноделие как искусство'