
7.3. Особенности культивирования дрожжей для игристых вин
В процессе метаболизма дрожжевые клетки ассимилируют многие вещества, используя их, а также продукты их распада для получения энергии и построения новых биополимеров. Для нормальной жизнедеятельности дрожжам необходимы вода, макроэлементы (С, О, Н, N, S, Р, К, Са, Fe, Mg), витамины и микроэлементы (Mn, Zn, Сu, Mo, Na, Со, Ni, Va, С1, В, Si и др.). Источниками углерода, кислорода и водорода служат углеводы и некоторые другие органические соединения (кислоты, спирты, альдегиды и др.). Дрожжи активно потребляют также молекулярный кислород, который усиливает их дыхательную функцию и активизирует процессы размножения. В качестве источника азота дрожжевые клетки используют аммиак, аминокислоты, амиды, соли аммония и, вероятно, пептиды. Имеются данные об адсорбции белков и ферментов дрожжами, при этом белки гидролизуются, а образовавшиеся аминокислоты потребляются дрожжами. Атомы серы и фосфора, входящие в состав аминокислот, белков, нуклеиновых кислот и других компонентов клетки, играют важнейшую роль в метаболизме дрожжей. Дрожжи хорошо ассимилируют сульфаты и соли ортофосфорной кислоты. Ионы калия регулируют рост дрожжевых клеток, в отсутствии калия дрожжи не размножаются. Крайне необходимы дрожжевым клеткам катионы железа, магния и микроэлементы, так как они входят в состав ферментов. Стимуляторами роста дрожжей являются многие витамины, большинство из которых известны как коферменты. Кроме того, решающее значение имеют рН среды и температура.
Питательные вещества поступают в клетку через клеточную стенку и цитоплазматическую мембрану. Механизм проникновения компонентов из питательной среды в клетку чрезвычайно сложен и до конца не изучен. Считается, что при этом происходит как "пассивная", так н "активная" диффузия. При "активном переносе" вещество соединяется с белком (ферментом), расположенным на мембране дрожжей, при этом расходуется энергия АТФ. Таким образом, поглощаться может только тот субстрат, для которого в клетке имеется специфичный транспортный механизм. В отличие от этого ряд веществ проникает в клетку вследствие разницы концентраций их внутри клетки и в среде.
Компоненты, поступившие в дрожжевую клетку, трансформируются, при этом образуются продукты обмена, которые выделяются в среду, накапливается энергия и синтезируются новые соединения. Образующиеся биополимеры используются для замены клеточных структур и построения новых органоидов. Существует тесная связь между питанием, ростом и развитием дрожжей. Быстро растущие клетки эффективно используют питательные вещества на биосинтез клеточных компонентов и воспроизведение новых клеток.
В процессе своего роста и развития дрожжевые клетки размножаются путем почкования и деления. Период, в течение которого отделившаяся от материнской молодая клетка достигает максимальной величины и сама начинает размножаться, называют продолжительностью генерации. Выделяют 5 основных стадий развития дрожжей:
I - лаг-фаза (фаза задержки роста). В этот период, следующий после внесения культуры в питательную среду, дрожжевые клетки приспосабливаются к среде, но еще не размножаются;
II - экспоненциальная фаза, характеризуется максимальной скоростью деления клеток;
III - фаза замедленного роста, в течение которой размножающиеся клетки полностью потребляют питательные вещества среды и накапливают продукты метаболизма, тормозящие процесс размножения;
IV - стационарная фаза. Концентрация клеток становится максимальной и остается постоянной;
V - фаза отмирания. Количество клеток снижается вследствие их отмирания и автолиза.
Для каждой из описанных фаз характерны определенные скорости размножения, морфологические и физиологические свойства клеток. Это обусловливается теми биохимическими процессами, которые протекают внутри клеток.
Процесс культивирования дрожжей зависит от состава питательной среды, температуры, режима аэрации, интенсивности перемешивания и других факторов, которые могут лимитировать скорость роста культуры.
Состав питательной среды должен обеспечивать высокую скорость размножения и выход биомассы. Многие авторы (Н. Ф. Саенко, Е. И. Квасников, Н. Г. Саришвили, Н. И. Бурьян) используют для культивирования дрожжей естественные питательные среды, в частности виноматериалы для игристых вин. Для интенсификации процесса рекомендуют добавки аммиачного азота [16, 91 и др.]. В ряде стран применяют искусственные питательные среды, после чего отделяют биомассу дрожжей от культуральной жидкости. Среда для размножения должна содержать источники углерода, азотистые вещества, соли, микроэлементы. Было установлено [91], что выращивание дрожжей, можно проводить на виноматериалах без сахара или при низкой сахаристости (4-6 г/л) (табл. 19). При более высокой сахаристости наблюдается репрессия глюкозой процесса дыхания, понижается активность дыхания, сахар используется неэкономично, снижается выход биомассы, уменьшаются размеры клеток. Добавка аммиака вызывает существенное увеличение выхода дрожжей: при повышении содержания азота аммиака с 14 до 50 мг/л концентрация клеток в дрожжевой разводке возрастает с 45 до 240 млн./мл.
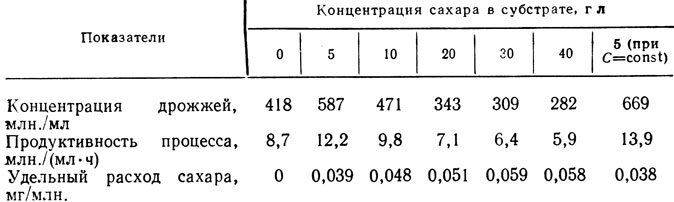
Таблица 19
Температура оказывает большое влияние на метаболизм дрожжей. Максимальная активность дыхания дрожжей при рН 3 проявляется при 20 °С [96].
Режим аэрации может вызывать активирование или торможение роста микроорганизмов. Для каждого микроорганизма существует определенная минимальная концентрация кислорода в среде (0,01-0,02 ммоль О2 на 1 л среды), ниже которой недостаток кислорода лимитирует рост.
Интенсивность перемешивания зависит от конструкции перемешивающих устройств, формы аппарата, свойств культуральной жидкости. Повышенная скорость перемешивания, обеспечивающая улучшение массообмена, в сочетании с пониженным содержанием сахара в среде стимулирует процесс размножения дрожжей (табл. 20). Максимальный выход дрожжей (960 млн./мл) наблюдается при коэффициенте массоотдачи 885 ч-1. В промышленной установке максимальная продуктивность процесса и минимальный удельный расход сахара достигаются при скорости разбавления 0,025 ч-1 [96].
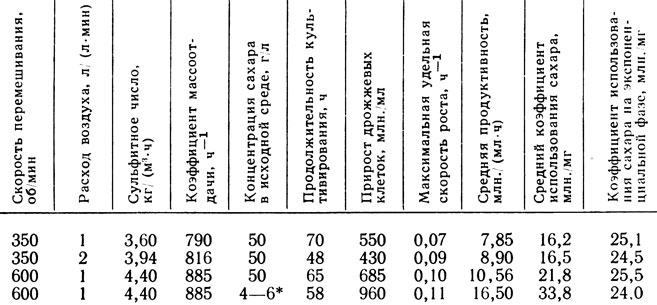
Таблица 20
*(В течение всего опыта поддерживалась на постоянном уровне.)
Учет факторов, влияющих на культивирование дрожжей, и выбор оптимальных технологических режимов позволили разработать новые принципы культивирования дрожжей для игристых вин [91, 96 и др.].
Процесс культивирования дрожжей сопровождается интенсивными биохимическими превращениями компонентов среды [3]. Аэрация накладывает существенный отпечаток на биохимические реакции в дрожжевых клетках, их состав и структуру. Аэробно выращенные клетки в отличие от анаэробных менее богаты гликогеном, волютином и азотистыми соединениями, а также имеют меньшие размеры и массу. Значительно подвержен колебаниям и ферментный состав дрожжевой клетки, особенно комплекс дыхательных ферментов. Амплитуда изменения активности ферментов дрожжевой клетки при переходе из аэробных условий в анаэробные связана с положением фермента в цепи переноса электронов. Терминальный фермент (цитохромоксидаза), который непосредственно реагирует с молекулярным кислородом, изменяется наиболее сильно. В отсутствии кислорода в дрожжах падает активность лактат-, малат- и изоцитратдегидрогеназы. У дрожжей, лишенных длительное время кислорода, отсутствуют цитохромоксидаза и цитохром в, уменьшается содержание цитохрома с. Однако при аэрации анаэробно выросших дрожжей происходит синтез типичных аэробных цитохромов.
В связи с тем что при поточном производстве шампанского полученная биомасса дрожжей поступает на шампанизацию вместе с культуральной жидкостью, представляет интерес изменение ее состава с точки зрения тех продуктов метаболизма клетки, которые могут отрицательно сказаться на качестве шампанского. Анализы дрожжевой разводки, поступающей в линию шампанизации на ряде заводов, показали, что в отдельных случаях в культуральной жидкости накапливается большое количество альдегидов, что обусловлено в основном аэрацией. Так, при выращивании на шампанском виноматериале без сахара или с небольшим его содержанием (2,4%) при аэрации вина дрожжи после 24 ч культивирования накапливают альдегидов до 400 мг/л, на среде с 5,9% сахара они синтезируют до 260 мг/л альдегидов, а на среде с 11%-190 мг/л. Основная часть альдегидов дрожжевой разводки при аэрации образуется из этилового спирта. Глюкоза и фруктоза в небольшой мере обогащают культуральную жидкость альдегидами, расходуясь главным образом на биосинтез биомассы дрожжей. При глубинной ферментации вин с аэрацией дрожжи интенсивно окисляют спирт в уксусный альдегид, реакция полного окисления этанола имеет меньшее значение.
Окисление содержащегося в питательной среде этанола в ацетальдегид катализируется алкогольдегидрогеназой дрожжей. В дрожжевых клетках присутствуют 2-3 ее изоэнзима, один из которых специфичен к этанолу и катализирует реакцию его дегидрирования, а другой ответствен за способность дрожжей использовать этанол в качестве субстрата.
Большое влияние на обмен дрожжей оказывает концентрация глюкозы. Окислительный обмен начинает преобладать над гликолитическим лишь после полного использования глюкозы дрожжами. Это обусловливается репрессирующим действием глюкозы на синтез ферментов окислительного метаболизма.
У S. cerevisiae глюкоза подавляет синтез алкоголь- и малатдегидрогеназ, изоцитратлиазы, мелатсинтетазы, НАД-глютаматдегидрогеназы. Повышение степени репрессии клеток дрожжей приводит к снижению окислительной активности изолированных митохондрий, в результате чего тормозится реакция дегидрирования этанола.
Наряду с альдегидами в культуральной жидкости накапливаются повышенные количества (2-5 мг/л) диацетила, который при концентрации свыше 0,8 мг/л вызывает появление тона окисленности. Размножающиеся дрожжевые клетки интенсивно ассимилируют азотистые вещества и особенно аминокислоты. При культивировании дрожжей без аэрации содержание аминокислот в вине за три дня снижается почти в 2 раза. В условиях аэрации к концу воспроизводства дрожжей в вине почти не остается аминокислот.
Таким образом, при воспроизводстве дрожжей в питательной среде происходят интенсивные изменения составных компонентов. Аэрация, способствуя повышению выхода биомассы, вызывает глубокие окислительные процессы, вследствие чего происходит дегидрирование этанола, окислительное дезаминирование аминокислот и в среде накапливаются значительные количества свободного ацетальдегида, диацетила и других веществ. В связи с этим следует обращать серьезное внимание на режимы аэрации и не допускать глубоких изменений химического состава питательной среды. При чрезмерном накоплении в культуральной жидкости нежелательных компонентов и значительном ухудшении качества вина следует проводить предварительное сепарирование дрожжевой разводки и вводить на шампанизацию густую суспензию дрожжей. Указанное позволит исключить попадание в шампанизируемое вино культуральной жидкости и повысить качество шампанского.
На основании проведенных исследований был предложен способ производства дрожжей для виноделия [5], предусматривающий отделение дрожжевых клеток от питательной среды, улавливание выделяющихся при аэрации углерод- и азотсодержащих веществ, обогащение культуральной жидкости компонентами, необходимыми для размножения дрожжей, замораживание и лиофилизацию дрожжевых клеток.
По данным Н. Г. Саришвили [96], накопление альдегидов и диацетила происходит в период лаг-фазы, при этом культуральная жидкость приобретает тона окисленности. После накопления дрожжевой биомассы усиливаются восстановительные процессы, приводящие к снижению ОВ-потенциала и содержания альдегидов. Выдержка дрожжевой разводки в анаэробных условиях улучшает окислительно-восстановительные показатели в вине. Кроме того, после аэробного выращивания целесообразна подготовка дрожжевых клеток к жизнедеятельности в анаэробной среде. Учитывая указанное, был предложен [96] технологический прием, названный "активация дрожжей", предусматривающий выдержку дрожжевой разводки без доступа воздуха при температуре 8-10 °С и давлении 470-500 кПа в течение 3-5 ч, дающий возможность перестроить обмен с дыхания на брожение и восстановление аэробных продуктов обмена.
Дрожжи для производства игристых вин культивируют периодическим и непрерывным способами.
Периодический способ приготовления разводок дрожжей чистой культуры заключается в постепенном наращивании биомассы. Разводку чистой культуры дрожжей начинают готовить в лаборатории. С этой целью в пробирку с 10 мл свежей питательной среды (купаж обработанных виноматериалов с добавкой ликера до содержания сахара в среде 2-6 г на 100 мл), подвергнутой стерилизации (для стерилизации среду нагревают до 85-90 °С и выдерживают 15 мин), вносят культуру дрожжей. После размножения в период бурного брожения содержимое пробирки переливают в колбу вместимостью 250 мл со 100 мл питательной среды. Активно бродящую суспензию наливают в литровую колбу с 500 мл питательной среды, содержимое которой в стадии бурного брожения переливают в трехлитровую колбу с 1700 мл среды. Полученную разводку чистой культуры активно бродящих дрожжей переливают в дрожжевой аппарат и получают пятую генерацию дрожжей, которую используют в производстве. Производственные разводки дрожжей готовят на обработанных купажированных виноматериалах с добавкой ликера или бродильной смеси, которые предварительно подвергают стерильной фильтрации или пастеризации.
Культивирование дрожжей периодическим способом в производственных условиях проводят в специальных аппаратах с устройствами для перемешивания и аэрации. Питательную среду заливают в аппарат, в котором 1/3 объема заполнена свежей дрожжевой разводкой, включают мешалку и дозируют стерильный воздух. Когда в дрожжанке накопится необходимое количество дрожжевых клеток, аэрацию прекращают и 2/3 полученной разводки используют для вторичного брожения. К оставшейся массе добавляют новую питательную среду, и цикл повторяют. Описанный способ имеет ряд существенных недостатков, в частности полученные дрожжевые клетки обладают неодинаковой и зачастую невысокой физиологической активностью.
Усовершенствованный в СССР периодический способ предусматривает раздельное дозирование компонентов питательной среды (виноматериала и ликера) для постоянного поддержания оптимальной концентрации сахара в культуральной жидкости на уровне 5-7 г/л, а также добавление к среде раствора аммиака для повышения содержания аммиачного азота до 70 мг/л. Перемешивание среды осуществляется мешалкой со скоростью не более 600 об/мин или непрерывной циркуляцией среды центробежным насосом из нижней части аппарата в верхнюю для распыления ее в наджидкостном пространстве через кольцевой перфорированный распылитель. В процессе культивирования при температуре не выше 18 °С среду аэрируют из расчета до 0,5 л воздуха в 1 мин на 1 л культуральной жидкости. За 3-5 ч до направления разводки на вторичное брожение аэрацию прекращают. Рекомендуется полученную дрожжевую разводку адаптировать в том же аппарате к температурным условиям вторичного брожения. Из аппарата отбирают 70-75% разводки для производственных нужд, к оставшейся суспензии добавляют свежую питательную среду и начинают новый цикл культивирования. Данный способ позволяет интенсифицировать процесс размножения, создать оптимальные условия для повышенного накопления физиологически активных дрожжевых клеток.
Непрерывное культивирование дрожжей является одним из наиболее эффективных средств управления обменом веществ, ростом и развитием микроорганизмов. При непрерывном процессе в отличие от периодического обеспечиваются постоянные условия роста, клетки получают необходимое количество питательных веществ, благодаря чему поддерживается их стабильное физиологическое состояние, появляется возможность регулирования процесса, обеспечения высокой продуктивности. При непрерывном культивировании происходит генетическая перестройка, образуются мутанты, более приспособленные к среде, т. е. имеет место селекция и адаптация клеток, селекция перспективных штаммов. Автоселекционность непрерывного культивирования благоприятствует повышению продуктивности процесса.
Н. Д. Иерусалимским предложена следующая классификация непрерывных методов:
- непрерывный без проточных сред (например, отъемный метод выращивания маточных дрожжей);
- прерывисто-проточный (проточно-циклический) с использованием твердой фазы или без нее;
- гомогенно-непрерывный с одинаковыми условиями во всех точках аппарата;
- градиентно-непрерывный в батарее аппаратов, в колонке с секциями или аппарате с твердым наполнителем.
Непрерывное культивирование дрожжей для игристых вин было предложено Е. И. Квасниковым и Н. Г. Саришвили в 1963 г. Вначале был разработан градиентно-непрерывный способ, который заключается в выращивании дрожжей в батарее аппаратов с неодинаковыми условиями культивирования и градиентом концентрации питательных веществ в разных аппаратах. Позднее был предложен гомогенно-непрерывный способ, предполагающий размножение дрожжей в одном аппарате с хорошо перемешиваемой средой и одинаковой скоростью поступления питательных веществ и выхода дрожжевой разводки из аппарата [91].
Градиентно-непрерывный способ предусматривает приготовление дрожжей в системе последовательно соединенных аппаратов, каждый из которых снабжен перемешивающими и аэрирующими устройствами и рубашками для регулирования температуры (рис. 9). Культивирование дрожжей осуществляют на питательной среде, содержащей 20-40 г/л сахара, при непрерывном перемешивании для равномерного диспергирования дрожжевых клеток и аэрации. Подачу воздуха постепенно уменьшают от первого аппарата, который аэрируют из расчета 0,6-0,8 л/ч на 1 л жидкости, к последнему, в котором аэрацию прекращают. Температуру в первом аппарате поддерживают не выше 15°С, постепенно снижая к последнему до уровня температуры в последнем аппарате бродильной батареи. Отмеченные градиенты температуры и аэрации обусловлены необходимостью подготовки дрожжевых клеток к условиям вторичного брожения.
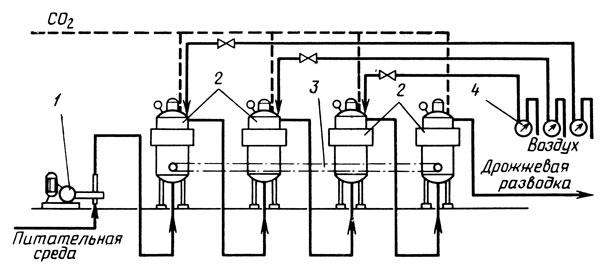
Рис. 9. Установка для культивирования дрожжей градиентно-непрерывньм способом: 1 - насос-дозатор; 2 - аппарат дрожжевой; 3 - перемешивающие устройства; 4 - счетчики расхода воздуха
В пусковой период дрожжевые аппараты загружают питательной средой (купажом и ликером) и дрожжевой разводкой, начиная с последнего, с интервалами в 10-12 ч. После заполнения всех аппаратов и начала размножения дрожжей в 1-м аппарате в него начинают непрерывно дозировать питательную среду при непрерывном перемешивании и аэрации. Культуральная жидкость со взвешенными клетками дрожжей перетекает по трубопроводам из первого в последующие аппараты. В последнем аппарате в анаэробных условиях при низкой температуре дрожжевая разводка подготавливается к условиям вторичного брожения и направляется в резервуары для шампанизации.
Гомогенно-непрерывный способ предусматривает приготовление дрожжей в одноемкостной системе или спаренной установке [А. с. 492541 (СССР).-Б. И., 1975, № 43; А. с. 520396 (СССР).-Б. И., 1976, № 25; А. с. 529209 (СССР).- Б. И., 1976, № 35]. Аппарат снабжен перемешивающим, аэрирующим и пеногасящим устройствами, а также системой для регулирования температуры (рис. 10). В аппарат непрерывно дозируют купаж и ликер для постоянного поддержания содержания сахара в культуральной жидкости в пределах 5-7 г/л, а также раствор аммиака до концентрации 10-15 мг/л аммиачного азота. Среду аэрируют из расчета не более 0,5 л воздуха в 1 мин на 1 л жидкости. Культуральную жидкость центробежным насосом непрерывно перекачивают из нижней части аппарата в верхнюю, распыляя в наджидкостном пространстве через кольцевой перфорированный распылитель для равномерного диспергирования дрожжевых клеток и устранения пенообразования. Перемешивание можно осуществлять установленной внутри аппарата мешалкой, обеспечивающей 400-600 об/мин.
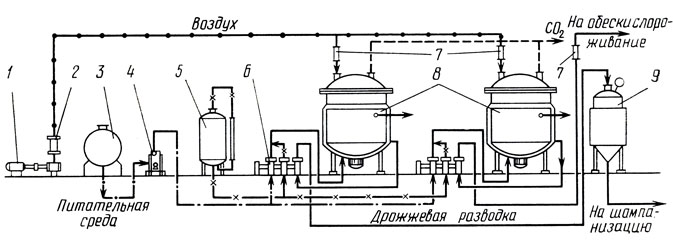
Рис. 10. Способ культивирования дрожжей гомогенно-непрерывным способом: 1 - воздуходувка; 2 - воздушный фильтр; 3 - резервуар для купажа; 4 - фильтр; 5 - резервуар для ликера; 6 - агрегат дозирующий; 7 - ротаметр; 8 - дрожжевой аппарат; 9 - активатор
Культивирование дрожжей в аппарате проводят при 18-20 °С в течение 2,0-2,5 сут при коэффициенте потока 0,020-0,015. Готовую дрожжевую разводку отбирают из аппарата и используют в производстве. Перед вторичным брожением разводку рекомендуется адаптировать путем выдержки в течение 3-5 ч в специальном аппарате - активаторе в анаэробных условиях при температуре и давлении, при которых осуществляют процесс вторичного брожения.
Непрерывные способы культивирования позволяют получать разводку с высокой концентрацией физиологически активных дрожжевых клеток.
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://wine.historic.ru/ 'Виноделие как искусство'