
Раздел V. Химия и технохимический контроль виноделия (Э. М. Шприцман, В. В. Андреев, С. Ш. Шапошник)
Общие сведения по химии
Характеристика реактивов
Для квалификации химических реактивов по степени их чистоты приняты следующие обозначения и условные сокращения: 1) технические (техн.); 2) очищенные (оч.); 3) чистые (ч.); 4) чистые для анализа (ч. д. а.); 5) химические чистые (х. ч.); 6) для рН-метрии. Встречаются также обозначения: особой чистоты (ос. ч.) и высшей очистки (в. оч.).
В аналитической практике применяют преимущественно реактивы квалификации ч. д. а. и х. ч., иногда - ч.
Растворы и концентрация
Раствором называют однородную смесь, состоящую из растворенного вещества, растворителя и продуктов их взаимодействия.
Концентрацией раствора называют массовое или объемное количество растворенного вещества, содержащееся в определенном количестве раствора (или растворенное в определенном количестве растворителя).
Наиболее часто встречающиеся выражения концентрации растворов:
процент массовый, А - масса вещества (г), растворенного в 100 массовых единицах (г) раствора;
процент объемный, Б - объем вещества (мл), растворенного в 100 объемных единицах (мл) раствора;
процент объемно-массовый (условный), В - масса вещества (г), растворенного в 100 объемных единицах (мл) раствора;
промилле, С - масса вещества (г), растворенного в 1000 объемных единицах (мл) раствора;
нормальность, N - число грамм-эквивалентов вещества, растворенного в одном литре раствора;
молярность, М - число грамм-молекул вещества, растворенного в одном литре раствора.
Характеризуя растворимость вещества Р, выражают концентрацию насыщенного при данных условиях (температура, а для газов - и давление) раствора в граммах на 100 г чистого растворителя.
В аналитической химии концентрацию выражают также титром Т - количеством граммов вещества, содержащегося в 1 мл раствора.
Различают титр по рабочему веществу - количество граммов рабочего вещества в 1 мл его раствора - и титр по определяемому веществу - количество определяемого вещества, оттитровываемое одним миллилитром рабочего раствора.
Титр и нормальность раствора связаны выражением
N = T·1000/E,
где Е - эквивалентная масса рабочего или определяемого вещества.
При выражении концентрации рабочего раствора через нормальность пользуются поправочным коэффициентом, который обозначают буквой К с индексом рабочего раствора, например КNaОН. Поправочный коэффициент показывает, во сколько раз нормальность данного раствора больше или меньше его теоретической нормальности.
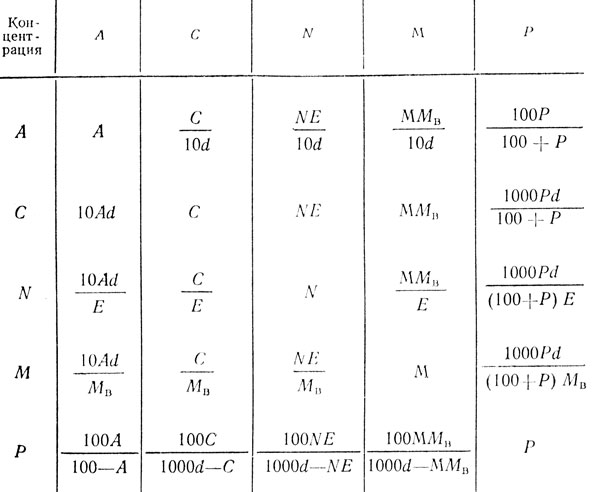
Таблица 42. Формулы перевода некоторых выражений концентраций растворов
Обозначения: Мв - молекулярная масса растворенного вещества;
Е - эквивалентная масса растворенного вещества;
d - относительная плотность раствора.
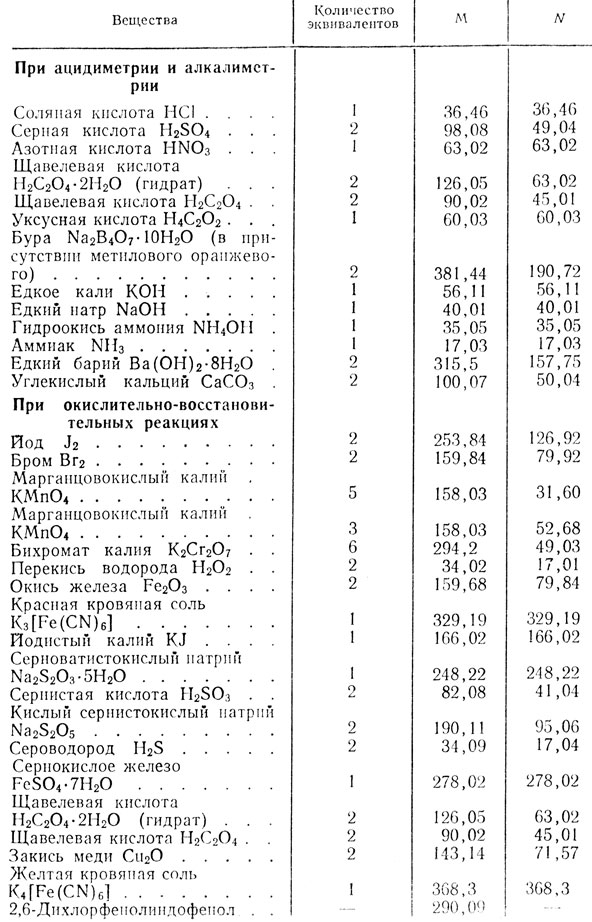
Таблица 43. Эквивалентные массы наиболее употребительных веществ

Кислотно-щелочные индикаторы
Растворы с определенной концентрацией ионов водорода, которая незначительно меняется от разбавления (концентрирования), добавления небольших количеств сильной кислоты или щелочи, называются буферными. Буферные растворы приготовляют из реактивов квалификации "для рН-метрии" на дистиллированной воде, из которой должна быть удалена растворенная углекислота (кипячением в течение 30-40 мин).
Для настройки рН-метров применяют стандартные буферные растворы.
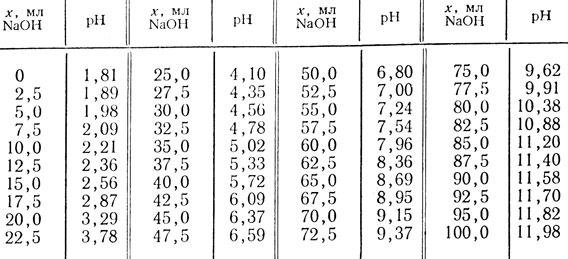
Таблица 44. Универсальная буферная смесь*
* (Для получения требуемого рН к 100 мл раствора, содержащего уксусную, фосфорную и борную кислоты, по 0,04 М каждой, добавляют х мл 0,2 н. раствора NaOH.)
Жесткость воды
Жесткость воды - мера содержания растворенных в ней солей Са и Mg. Различают постоянную, временную и общую жесткость.
Постоянная жесткость (некарбонатная) Жп - обусловлена содержанием сульфатов, хлоридов и других (кроме бикарбонатов) солей. При кипячении воды они остаются в растворе.
Временная жесткость (карбонатная) Жвр - обусловлена содержанием бикарбонатов. При кипячении бикарбонаты переходят в нерастворимые карбонаты и вода умягчается.
Общая жесткость обусловлена общим содержанием солей Са и Mg:
Ж = Жп + Жвр.
Жесткость воды в настоящее время выражают в мг-экв Са++ + +Mg++ в 1 л воды (мг-экв/л). Прежде ее выражали в градусах жесткости: 1° - 1 ч. СаО в 100000 ч. воды или 10 мг СаО в 1 л воды; 1 ч. MgO эквивалентна 1,4 ч. СаО. Один мг-экв/л жесткости соответствует 2,804 градусам жесткости; 1° = 0,35663 мг-экв/л.

Таблица 45. Характеристика воды по степени жесткости
Относительная плотность растворов, применяемых в виноделии
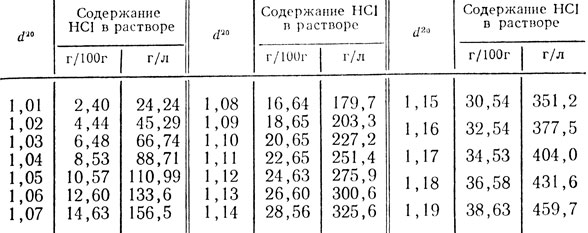
Таблица 46. Относительная плотность водных растворов соляной кислоты при 20°С (d20)
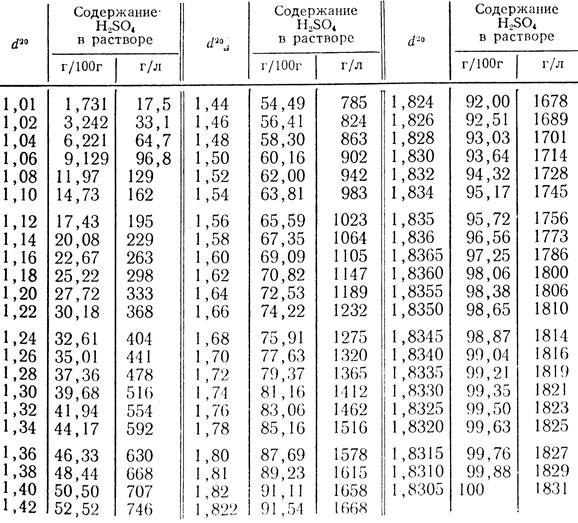
Таблица 47. Относительная плотность водных растворов серной кислоты при 20°С (d20)
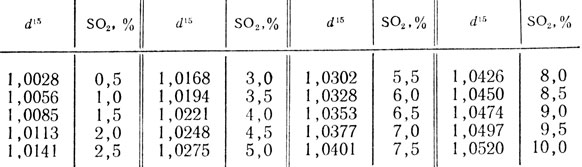
Таблица 48. Относительная плотность водных растворов SО2 при 15°С (d15)
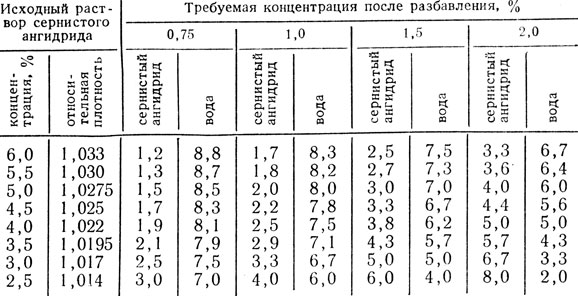
Таблица 49. Таблица разбавления для получения 10 л раствора SО2 требуемой концентрации (в л)
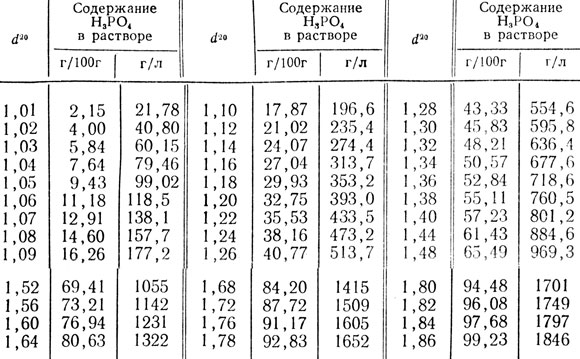
Таблица 50. Относительная плотность водных растворов ортофосфорной кислоты при 20°С (d20)
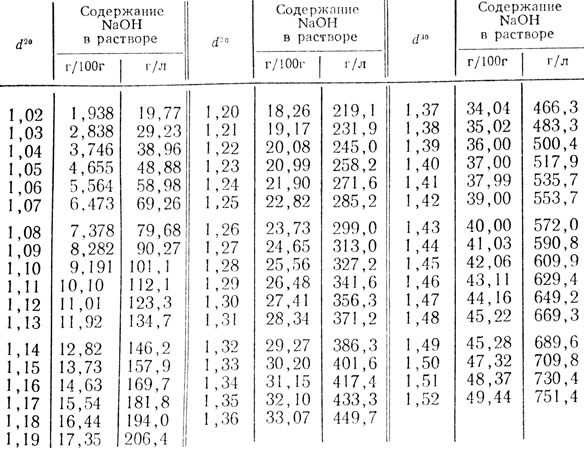
Таблица 51. Относительная плотность водных растворов едкого натра при 20°С (d20)
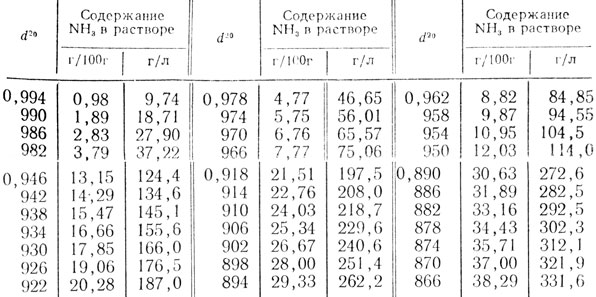
Таблица 52. Относительная плотность водных растворов аммиака при 20°С (d20)
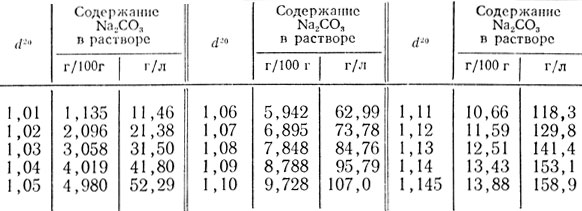
Таблица 53. Относительная плотность водных растворов углекислого натрия при 20°С (d20)
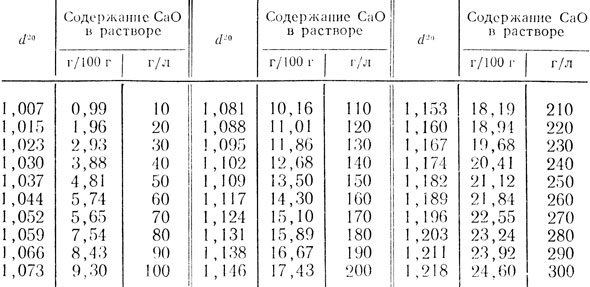
Таблица 54. Относительная плотность известкового молока при 20°С (d20)
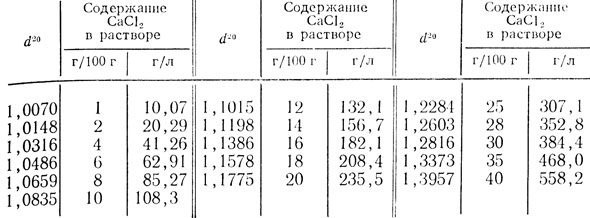
Таблица 55. Относительная плотность водных растворов хлористого кальция при 20°С (d20)
Распространенные названия некоторых химических веществ, применяемых в винодельческом производстве

Таблица 56
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://wine.historic.ru/ 'Виноделие как искусство'