
Культивирование дрожжей в непрерывном потоке
При шампанизации вина в непрерывном потоке к дрожжевой разводке предъявляют ряд специфических требований. Прежде всего она должна иметь возможно более высокую концентрацию физиологически активных клеток при низком окислительно-восстановительном потенциале культуральной жидкости и невысоком содержании в ней продуктов аэробного обмена дрожжей. Дрожжи при этом, пройдя аэробную стадию размножения, к концу культивирования должны быть подготовлены к брожению в анаэробных условиях. Следовательно, многофазность культивирования дрожжей в потоке и необходимость дифференциации условий потребовали организацию процесса в последовательно соединенных ферментерах. При определении их количества учитывали также обеспечение минимально возможного изменения условий культивирования от предыдущего ферментера к последующему. В результате предварительного экспериментирования число ферментеров в батарее было принято равным пяти.
При разработке аппаратурно-технологической схемы установки исходили из наличия соответствующего оборудования и приборов, серийно изготовляемых отечественной промышленностью.
Установка для культивирования дрожжей в непрерывном потоке (см. рис. 37) состоит из последовательно соединенных аппаратов (ферментеров). Каждый аппарат оборудован перемешивающим и аэрирующим устройствами. Создание стерильных условий обеспечивается полной герметизацией и установкой общего гидравлического затвора, заполненного антисептической жидкостью, что одновременно создает избыточное давление внутри каждого ферментера около 1500 Па. Для исключения контакта культуральной жидкости с атмосферой применена запорная арматура диафрагмового типа. Запорная арматура с сальниковыми устройствами для этих целей непригодна, поскольку при смачивании их изнутри культуральной жидкостью создаются благоприятные условия для развития посторонней микрофлоры. Аппараты соединены между собой трубопроводами с запорной арматурой по схеме, предусматривающей возможность отключения любого из них без остановки потока.
Воздух для аэрации культуральной жидкости подают в ферментеры от воздуходувки по стационарным трубопроводам через фильтр и индивидуальные дозирующие устройства. Контроль и регулирование заданных параметров процесса культивирования осуществляются автоматически.
Стерильную питательную среду (бродильную смесь) после дополнительной фильтрации непрерывно с заданным расходом подают в нижнюю часть первого ферментера. Из верхней части его культуральная жидкость с частью размножившихся дрожжевых клеток поступает в нижнюю часть второго ферментера и далее проходит через все ферментеры. По мере перетока субстрата происходит непрерывное увеличение количества дрожжевых клеток. Скорость роста биомассы в каждом ферментере регулируют созданием оптимальной температуры и аэрированием при непрерывном перемешивании. Готовую дрожжевую разводку из последнего ферментера непрерывно отбирают и используют для биологического обескислороживания купажа и вторичного брожения.
Для интенсификации процесса размножения, преимущественно в период пуска установки, можно производить непрерывный возврат 8-10% Дрожжевой разводки из последнего ферментера в первый с помощью эрлифтного устройства. Это устройство представляет собой воздушный подъемник, основанный на принципе сообщающихся сосудов. В один из сосудов снизу под давлением 15 кПа подают стерильный воздух, пузырьки которого насыщают дрожжевую разводку. Вследствие уменьшения плотности она поднимается по трубке и поступает в первый ферментер. Производительность работы эрлифтной установки регулируют дозировкой воздуха. Количество воздуха, необходимое для возврата дрожжей, регулируемое индикатором-расходомером РС-3А, определяют эмпирически.
Испытано ведение процесса размножения дрожжей также в "замкнутом цикле", когда шампанизируемое вино с дрожжами из верхних слоев третьего или четвертого бродильных аппаратов одной из линий шампанизации через эрлифтное устройство подавали в первый ферментер (2-3% от его часовой производительности). Исследования показали, что при установившемся режиме в бродильных аппаратах линий шампанизации наиболее физиологически активные клетки находятся во взвешенном состоянии. Клетки в осадке по своим бродильным свойствам во много раз менее активны, чем взвешенные. Направляя дрожжи, находящиеся в верхних слоях шампанизируемого вина, в первый ферментер для размножения, можно обеспечить непрерывную селекцию их наиболее активных форм. Это позволяет быстрее производить адаптацию дрожжей к условиям непрерывной шампанизации и особенно повышать бродильную активность при пониженных температурах. Дрожжи при этом характеризуются не только большой метаболической активностью, но и повышенной чувствительностью к внешним факторам, в условиях которых они проявляют наибольшую пластичность и способность к направленной изменчивости своих свойств [52].
Одним из основных факторов, влияющих на функциональную деятельность дрожжей, является состав питательной среды, который должен обеспечивать активность процесса обмена веществ и в то же время быть близким к составу шампанизируемого вина в резервуарах бродильной батареи. При этом приспособляемость дрожжей к процессу размножения и брожению в производственных условиях непрерывно повышается. Поэтому в качестве питательной среды рекомендуется использовать бродильную смесь, поступающую на шампанизацию.
В связи с отсутствием литературных данных о наиболее оптимальной концентрации сахара в питательной среде при непрерывном культивировании дрожжей были проведены исследования по изучению скорости размножения дрожжей на средах с разным содержанием сахара [88].
Опыты проводили на естественных средах, содержащих сахара от 1 до 10 г на 100 мл.
Динамику накопления биомассы дрожжей определяли по мутности суспензии на фотоэлектрическом колориметре-нефелометре (ФЭКН-56) через каждый час.
В табл. 6 приведены данные прироста дрожжей на средах с разной сахаристостью.
Таблица 6
Влияние содержания сахара в среде на размножение дрожжей
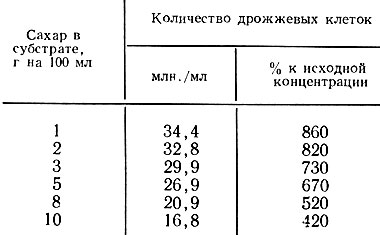
Исходная концентрация дрожжей в питательной среде 4 млн. клеток в 1 мл.
Наибольшей энергией размножения обладают дрожжи, культивируемые на средах с концентрацией сахара 1-3 г на 100 мл.
Следует отметить, что к концу опыта прирост биомассы дрожжей, культивируемых на среде с содержанием сахара 1 г на 100 мл, более чем в 2 раза превышает прирост в среде с 10 г сахара на 100 мл.
Энергию дыхания дрожжей на средах с разной сахаристостью определяли манометрическим методом в аппарате Варбурга.
На рис. 3 приведены результаты сравнительного изучения энергии дыхания дрожжей. Наибольшую скорость поглощения кислорода проявляют дрожжи на средах, содержащих 1-3 г сахара на 100 мл. Значительное снижение энергии дыхания дрожжей, культивируемых на средах, содержащих 8- 10 г сахара на 100 мл, очевидно, объясняется тем, что повышенная концентрация сахара оказывает консервирующее действие и в сочетании с ингибиторами роста отрицательно влияет на активность дыхания и скорость размножения дрожжей.
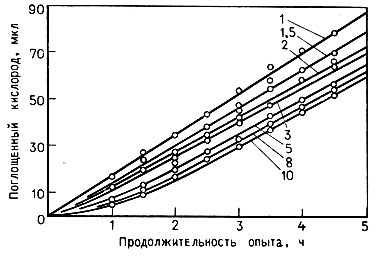
Рис. 3. Зависимость активности дыхания дрожжей от сахаристости среды (1; 1,5; 2; 3; 5; 8; 10 - содержание сахара в г на 100 мл)
Такие же результаты были получены при культивировании дрожжей и на искусственных средах.
В результате проведенных исследований установлено, что при отработанном режиме культивирования дрожжей в непрерывном потоке наиболее рационально в качестве питательной среды использовать бродильную смесь, приготовляемую для получения шампанизированного вина марки брют.
Специальные исследования проводились с целью дополнительной проверки установленной ранее возможности использования в качестве питательной среды бродильной смеси, содержащей сахара 2,0-2,2 г на 100 мл.
В условиях лабораторного опыта (в аппарате Варбурга) взятые для эксперимента дрожжи чистой культуры шампанской расы при температуре 15°С примерно 32% общего количества потребленного сахара израсходовали на дыхание. С учетом сопряженности в определенных условиях двух энергетических процессов - дыхания и брожения - было установлено количество сахара, израсходованного дрожжами на биосинтез клетки. Оказалось, что для получения 1 мг дрожжей было израсходовано около 3,1 мг сахара. Приняв условно количество клеток в готовой дрожжевой разводке равным 80 млн./мл, т. е. 0,8 мг/мл, получим: 0,8-3,1=2,48 мг сахара в 1 мл. Следовательно, для получения 80 млн. дрожжевых клеток на 1 мл достаточно было бы израсходовать сахара всего 2,48 г/л.
В производственных условиях расход сахара на биосинтез дрожжей и образование побочных продуктов их метаболизма является величиной относительно постоянной и, как известно, равной 8 г на 100 млрд. клеток чистого урожая. Следовательно, даже при максимальном расходе сахара для биосинтеза 80 млн. дрожжевых клеток на 1 мл. в производственных условиях сахаристость питательной среды должна составлять 6,4 г/л. При интенсивной аэрации расход сахара может быть снижен в 2,0-2,5 раза. Однако необходимо не только получить определенное количество биомассы дрожжей, но и подготовить их к анаэробным условиям вторичного брожения. Эта подготовка заключается в создании анаэробных условий в последнем ферментере и ведении процесса культивирования при постепенно понижающейся температуре. Размножение дрожжей к концу потока практически прекращается, а функция брожения усиливается, на что дополнительно, как показали исследования, потребляется 1,0-1,5 г сахара на 100 мл. Расход сахара на указанные цели может в 1,5-2,0 раза возрасти при нарушении режима культивирования.
Естественно, что указанное разграничение физиологических функций дрожжевой клетки во времени носит условный характер. В действительности эти процессы протекают сопряженно с переменной активностью в зависимости от условий культивирования.
Таким образом, иссследования подтвердили целесообразность использования для непрерывного культивирования дрожжей низкосахаристой питательной среды. При этом обязательным условием является строгое поддержание постоянства оптимальных взаимосвязанных параметров процесса. Если в производственных условиях нарушится хотя бы один из них, то содержащееся в среде количество сахара может оказаться недостаточным. В этом случае появится необходимость дополнительного введения сахара в питательную среду в виде ликера без коньячного спирта, количество которого в каждом конкретном случае определяют в зависимости от условий культивирования.
Так как дрожжи при непрерывной шампанизации находятся на пределе физиологических возможностей, представляют интерес поиски путей повышения их функциональной деятельности.
Значительное усиление функциональной деятельности дрожжей может быть обеспечено путем естественного обогащения питательной среды физиологически активными веществами.
Известно, что дрожжи в процессе своей жизнедеятельности синтезируют и выделяют в субстрат разнообразные органические соединения. Они являются одним из основных источников ферментов, витаминов, а также азотистых и других веществ, большинство из которых, являясь биологическими активаторами, вызывают сложные физиологические и биохимические процессы, обусловливающие в дальнейшем энергичный рост и размножение дрожжей.
Для повышения биологической ценности среды и усиления метаболической активности дрожжей разработан способ приготовления резервуарного ликера, отличающийся от существующих тем, что ликер (70-80% сахара) готовят при обычной температуре растворением сахарозы не в купаже, а в дрожжевой разводке, находящейся в физиологически активном состоянии. Обогащение ликера внутриклеточными веществами происходит в естественных условиях [135].
В связи с этим представляло интерес установить характер изменения активности ферментов в ликере, приготовленном на дрожжах, а также в ликере, приготовленном по общепринятой технологии. Растворение сахарозы (из расчета 80 г на 100 мл) как для контрольного, так и для опытного ликера проводили в одинаковых образцах купажа шампанских виноматериалов. В опытный ликер вводили трехсуточную культуру дрожжей, предварительно отмытых от продуктов их жизнедеятельности, - около 240-260 млн. клеток на 1 мл. Исследования проводили при температуре минус 5°С, плюс 20°С и плюс 35°С на 10, 20 и 30-й дни выдержки ликера.
Морфологические и культуральные исследования показали, что дрожжи в среде с повышенной концентрацией сахара претерпевают существенные изменения. В пробах опытного ликера, отобранных через 10 сут, было обнаружено уменьшение размеров дрожжевой клетки более чем в 2 раза. Характерно, что ликер, выдержанный в течение 10 сут, приобрел полную биологическую стерильность. Ферментативная активность опытного ликера значительно превосходит контроль.
В табл. 7 приведены средние данные изменения активности β-фруктофуранозидазы в зависимости от температурных условий выдержки ликера.
Таблица 7
Изменение активности β-фруктофуранозидазы (ед. фермента x ммоль/10 млн. клеток мин) в ликерах, приготовленных по обычной технологии (контроль) и на дрожжах (опыт), в процессе выдержки при различных температурах
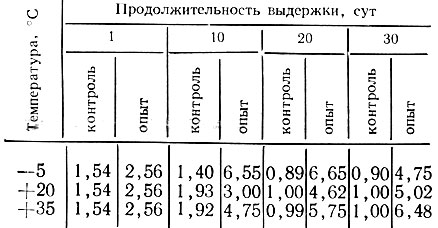
Активность β-фруктофуранозидазы опытного ликера уже в момент полного растворения сахарозы составляет 2,56 ед. фермента, а контрольного - 1,54, в то время как активность ферментов в купаже, который был использован для приготовления ликеров, 1,50 ед. фермента. Характерно, что при выдержке ликеров отмечается тенденция к некоторому повышению активности β-фруктофуранозидазы.
Значительное повышение ферментной активности установлено при выдержке дрожжевого ликера при температуре минус 5°С, причем максимальная активность β-фруктофуранозидазы обнаружена на 20-е сутки. Дальнейшая выдержка этого ликера приводит к снижению активности фермента.
Очевидно, это объясняется увеличением плотности ликера при низкой температуре, а также специфическими особенностями оболочки дрожжевой клетки.
Для изучения активности действия β-фруктофуранозидазы проводили определение количества инвертного сахара в процессе выдержки контрольного и опытного образцов ликеров без предварительной инверсии. Для сравнения искусственно инвертировали сахарозу в исследуемых образцах ликеров, при этом количество инвертного сахара было равно 82%.
Исследования показали, что процесс инверсии сахарозы быстрее проходил в опытном ликере при температуре 35°С. На 30-е сутки количество инвертного сахара в нем составило 74%, в то время как в контрольном ликере 57%. Медленнее всего гидролиз сахарозы проходил при температуре минус 5°С - в опытном образце 12%, а в контрольном 6%.
При определении эстеразы и протеазы в опытных ликерах также наблюдалось повышение их активности.
Изучение влияния исследуемых ликеров на физиологическую активность дрожжей (энергию брожения и дыхания) проводили в аппарате Варбурга на естественной питательной среде (вино + ликер).
Дрожжи, культивируемые на питательной среде, приготовленной с использованием опытного ликера, существенно повышают энергию брожения и дыхания. Характерно при этом, что энергия брожения по сравнению с энергией дыхания возрастает не менее чем в 2 раза.
При изучении влияния опытного ликера на изменение удельной энергии брожения установлено, что количество выделившегося углекислого газа на 60% больше у дрожжей, культивируемых на этом ликере. Энергия брожения дрожжей в средах, приготовленных на ликере, выдержанном при разной температуре, неодинакова. Наибольшую бродильную способность проявили дрожжи, культивируемые на ликере, выдержанном при минус 5°С.
Необходимо также отметить увеличение энергии дыхания доржжей, культивируемых на субстрате с опытными вариантами ликеров.
Таким образом, в результате проведенной работы определены некоторые пути повышения физиологических функций дрожжей в условиях шампанского производства [88].
Приведенное математическое обоснование закономерности непрерывного культивирования микроорганизмов может быть применимо и к условиям шампанского производства. При культивировании шампанских рас наличие динамического равновесия между коэффициентом скорости роста культуры c и коэффициентом разбавления r также обязательно. Поэтому питательную среду необходимо подавать с постоянным расходом, обеспечивающим активное равномерное размножение дрожжей преимущественно в первых ферментерах. В последующих ферментерах в результате уменьшения степени аэрации и постепенного понижения температуры углеводы и другие питательные вещества используются для биосинтеза клеток слабее, и процесс размножения их идет с плавно убывающей активностью. Одновременно с этим возрастает интенсивность брожения.
Условия непрерывного культивирования шампанских рас дрожжей динамичны, поэтому при установлении оптимальных режимов учитывали два основных фактора - количество клеток в единице объема субстрата x и продуктивность роста культуры P, т. е. количество биомассы, получаемой за 1 ч с единицы рабочего объема ферментера. Продуктивность каждого ферментера батареи может быть выражена уравнением P=cx. Как известно, между c и x существует обратная зависимость. Скорость роста бывает высокой при небольшой концентрации клеток. Когда же биомасса возрастает до значительных размеров, скорость роста снижается. Поэтому продуктивность достигает максимума примерно при средних значениях этих двух величин, когда биомасса культуры составляет 30-50% от максимально возможной. Таким образом, при необходимости получения биомассы в большом количестве следует устанавливать меньшую продуктивность и наоборот. Продуктивность роста культуры в значительной степени зависит также и от принятого режима культивирования.
Для получения дрожжей высокой физиологической активности, адаптированных к "жестким" условиям производства, и в достаточном количестве для осуществления нормального процесса вторичного брожения особое внимание было уделено изучению аэрации и перемешивания среды.
Основными факторами, определяющими интенсивный рост и размножение дрожжевых клеток, являются также аэрация и перемешивание. Эффект Пастера (см. с. 84) является предметом глубоких исследований и в настоящее время.
Происходящее при перемешивании равномерное диспергирование дрожжей в культуральной жидкости способствует повышению эффективности обмена веществ, поскольку поверхность каждой клетки в единицу времени контактирует с большим количеством молекул питательных веществ и кислорода воздуха. Наряду с этим происходит интенсивное удаление продуктов обмена, и в частности десорбция углекислоты. Учитывая положительное влияние перемешивания, следует иметь в виду, что лишенная движения дрожжевая клетка, использовав питательные вещества окружающей среды в сфере своего действия, угнетается недостатком питательных веществ и неблагоприятным влиянием продуктов своей жизнедеятельности.
Эффективность перемешивания для процессов размножения и брожения дрожжей изучалась многими авторами. Однако литературные данные, непосредственно касающиеся влияния аэрации и перемешивания на процесс непрерывного культивирования дрожжей в условиях шампанского производства, весьма ограничены. Поэтому в производственных условиях были проведены специальные исследования.
Первая серия опытов была посвящена изучению процесса непрерывного культивирования дрожжей при отсутствии аэрации и перемешивания. Вторую серию проводили с целью изучения влияния перемешивания при отсутствии аэрации. Опыты третьей серии преследовали цель выяснения влияния совокупности факторов.
В течение всего периода поддерживали постоянный расход питательной среды - 2,5 дал/ч, постоянную температуру, постепенно понижающуюся с 16°С в первом до 7°С в последнем ферментере. Продолжительность процесса культивирования составляла 100 ч при полезной емкости каждого ферментера 50 дал.
В опытах без аэрации и перемешивания дрожжи проявили недостаточно высокую активность размножения. Количество дрожжевых клеток возросло в среднем с 14,3 млн./мл в первом ферментере до 25,9 млн./мл в последнем. При этом почкующихся клеток оказалось 26,1%, а окрашивающихся метиленовой синью 5,4%.
Опыты второй серии показали, что непрерывное перемешивание культуральной жидкости оказывает стимулирующее влияние на процесс размножения дрожжей. Если в опытах первой серии среднее количество клеток составляло 25,9 млн./мл, то при наличии постоянного перемешивания оно возросло до 45,3 млн./мл, количество почкующихся клеток увеличилось до 61,8%, а окрашивающихся метиленовой синью снизилось до 2,8%.
Опыты, связанные с изучением одновременного влияния аэрации и перемешивания, первоначально проводили в одном ферментере непрерывного действия. Культуральную жидкость постоянно барботировали стерильным воздухом в различных режимах.
После установления основных закономерностей роста и размножения дрожжей при гомогенно-непрерывном способе представилась практическая возможность осуществления процесса культивирования их по градиентно-непрерывному способу и оптимизации этого процесса применительно к условиям шампанского производства. В табл. 8 приведена характеристика некоторых средних показателей непрерывного культивирования дрожжей по одному из оптимальных вариантов.
Таблица 8
Характеристика процесса культивирования дрожжей в непрерывном потоке
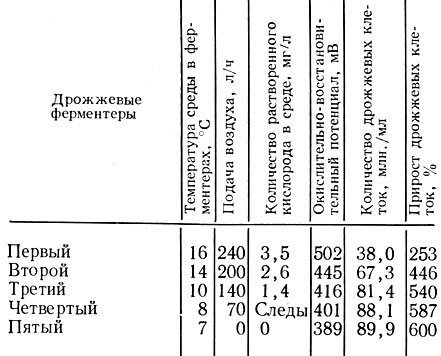
При этих условиях количество воздуха, подаваемое в каждый ферментер, постепенно уменьшают, а аэрацию последнего прекращают. Дрожжи почти полностью ассимилируют кислород среды четвертого ферментера, а в пятом растворенный кислород отсутствует. Тем не менее размножение дрожжей, наблюдаемое в этих ферментерах, по-видимому, объясняется тем, что некоторая часть кислорода сорбируется дрожжевой клеткой, которая в последующем способна размножаться в среде, практически лишенной растворенного кислорода.
Наибольшую скорость размножения дрожжи проявляли в течение первых 40 ч культивирования (в первых ферментерах). В последующих ферментерах активность размножения снижалась, тем не менее к концу процесса концентрация дрожжевых клеток достигала 89,Н млн./мл, в том числе почкующихся 55,4% и окрашивающихся метиленовой синью 1,6%.
Следует отметить, что в течение длительного культивирования дрожжей при указанных оптимальных условиях наблюдалось постоянное повышение их способности к размножению. Дрожжи достаточно быстро приобретали "саморегулирующие свойства", характерные для проточной культуры.
Применительно к конкретным условиям производства для оптимизации процесса непрерывного культивирования дрожжей необходимо экспериментальным путем уточнить отдельные технологические параметры. Вместе с тем проведенные исследования с учетом имеющегося опыта передовых предприятий позволяют рекомендовать промышленности следующие основные положения культивирования дрожжей в непрерывном потоке.
Применяемые в производстве шампанского расы дрожжей должны ежегодно централизованно проверяться специализированным научно-исследовательским учреждением.
Первоначально приготовление разводок дрожжей чистой культуры осуществляют постепенным накоплением биомассы и повышением их физиологической активности путем последовательных пересевов на питательные среды. Стерилизацию питательной среды обеспечивают нагреванием до 85-90°С и выдержкой при этой температуре в течение 15 мин.
Дрожжи размножают в пробирках с 10 мл питательной среды в каждой. В период бурного брожения содержимое десяти пробирок переливают в 250-миллилитровые колбы при тщательном взбалтывании.
В период бурного брожения содержимое 250-миллилитровых колб переносят в литровые колбы (по 500 мл питательной среды), а содержимое последних - в 3-литровые колбы (по 1700 мл питательной среды). Дрожжевую разводку из 3-литровых колб переводят в ферментеры, предварительно заполненные питательной средой с содержанием сахара 2-4 г на 100 мл. В качестве питательной среды целесообразно использовать бродильную смесь. В пусковой период ферментеры загружают последовательно от последнего к первому с интервалами 10-12 ч. Пуск установки производят после загрузки всех аппаратов. В первом дрожжевом аппарате обеспечивают активное размножение дрожжей при температуре около 16°С, в последующих температуру постепенно снижают. При этом в последнем ферментере поддерживают температуру, не превышающую температуру вина в последнем бродильном аппарате (биогенераторе) линии шампанизации. В процессе культивирования дрожжей среду непрерывно аэрируют стерильным воздухом. При этом подачу воздуха постепенно уменьшают от первого ферментера к последнему, который не аэрируют. Удельный расход стерильного воздуха в первом ферментере поддерживают в пределах 0,5-0,8 л/ч на 1 л культуральной жидкости.
В целях повышения эффективности обмена веществ дрожжей осуществляют непрерывное перемешивание культуральной жидкости во всех ферментерах с таким расчетом, чтобы при этом обеспечивались десорбция углекислоты и равномерное диспергирование дрожжевых клеток. Дрожжевую разводку на производственные цели непрерывно отбирают из последнего ферментера. При отработанном режиме культивирования установку продолжительное время эксплуатируют без перезарядок.
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://wine.historic.ru/ 'Виноделие как искусство'