
Состав обычной воды
Природная вода - это сильно разбавленные растворы солей, иногда и некоторых газов, содержащие суспендированные неорганические и органические вещества и микроорганизмы. Содержание минеральных веществ в воде качественно зависит от геологического характера местности, который определяет химический состав слоев, через которые вода проходит. От физических свойств этих слоев зависит и эффект естественной фильтрации воды как с физической точки зрения (суспендированные вещества), так и с биологической (микроорганизмы).
Природная вода обычного состава содержит наряду с ионами Н+ и ОН- катионы Са2+, Mg2+, Na+, К+, Fe 2+(реже Fe3+), Mn 2+ и анионы НСO3-, SO42-, SiO32, Сl-, NO3-.
Кальций Са2+ и магний Mg2+ являются постоянными компонентами любой природной воды. Кальций всегда преобладает, в то время как содержание магния редко превышает 30 мг/л. Содержание натрия Na+ и калия К+ в воде сильно колеблется. Чехословацкие производственные воды содержат большей частью только незначительные количества этих катионов. Железо в обычных водах встречается почти исключительно как двухвалентное, т. е. Fe2+. Ему, как правило, сопутствует алюминий Al3+ и иногда также марганец Mn2+ В хороших производственных водах должны содержаться только следы железа и главным образом марганца. Железо обычно допускается в количестве не больше 0,3 мг/л; остаточное содержание железа после искусственного удаления его из воды - от 0,05 до 0,10 мг/л.
Из анионов во всех природных водах содержится бикарбонат-ион HCO3- и сульфат-ион SO42-, часто также хлор-ион Cl- (от 19 до 30 мг/л). Силикат-ион SiO42- тоже является постоянным компонентом природных вод в количестве от 10 до 30 мг/л.
Аммиак H3 и аммониевые соединения NH4+ встречаются я природных водах как местные загрязнения, образующиеся в результате гниения азотсодержащих органических веществ. Деятельность нитрофицирующих бактерий ведет к окислению сначала в нитриты NO2-, а потом в нитраты NO3-.
Из газов, содержащихся в воде, особое значение имеет углекислый газ CO2, образующий с водой угольную кислоту H2CO3, под действием которой на известняковые породы вода приобретает временную жесткость. Часть свободного углекислого газа задерживают в растворе бикарбонаты едких земель, и такой углекислый газ называется равновесным, в то время как другие части являются агрессивными известняковым материалам. Железу агрессивен весь свободный углекислый газ.
Почти все природные воды содержат определенное количество органических веществ, количество которых определяется потребностью кислорода для их окисления. Нормальное содержание соответствует потреблению кислорода от следов до 2 мг/л; наибольшее от 0 до 50 мг/л.
Остаток после выпаривания воды, высушенный при 105°С, содержит все нелетучие неорганические и органические вещества и называется сухой остаток.
Обычные чехословацкие воды содержат 50-500 мг сухого остатка на 1 л; внешний предел от 20 до 2000 мг/л.
При анализе вод, предназначенных для технических целей, отдельные компоненты приводятся в миллиграммах ионов на 1 л воды. Иногда встречаются данные, пересчитанные на окислы (катионы-основания) и ангидриды кислот (анионы): CaO, MgO, Fe2O3 (или Fe), Na2O, SO3, SiO2, Na2O5, Cl и т. д. Наряду с этим при оценке воды для пивоварения обычные данные приводятся в мг-экв/л. Этот метод необходим при титровальных анализах, поскольку потребление любого реагента концентрацией 0,1 н. (в мл на 100 мл воды) соответствует по величине количеству мг-экв/л.
При определении пригодности вод для технических целей важным критерием является так называемая жесткость воды. Источником жесткости воды являются ионы щелочноземельных металлов Ca2+, Mg2+, иногда также Cr2+ и Ba2+ [1]. С присутствующим бикарбонат-ионом HCO3- они реагируют при кипячении следующим образом:
Ca2+ + 2HCO3- = CaCO3, + H2O + CO2,
Mg2+ + 2HCO3- = MgCO2 + H2O + CO2.
Из приведенных уравнений реакций следует, что часть ионов щелочноземельных металлов, эквивалентная бикарбонатным ионам, присутствующим в растворе, выделяется в виде нормальных нерастворимых в воде карбонатов; освободившийся углекислый газ при кипячении испаряется. Тем самым снижается жесткость воды на ту часть жесткости, которая называется временной (карбонатной жесткостью). И, наоборот, ионы щелочно-земельных металлов, эквивалентные присутствующим анионам сильных неорганических кислот, т. е. SO42-, Cl-, NO3- , при кипячении не реагируют один с другим и поэтому соответствующая им часть жесткости определяется как жесткость постоянная (некарбонатная).
Общая жесткость воды является суммой жесткости временной (карбонатной) и постоянной (некарбонатной).
В Средней и Восточной Европе единицей жесткости воды является немецкий градус (1°H), который соответствует 10 мг CaO или эквивалентной части MgO (иногда S2O и BaO) в 1 л воды
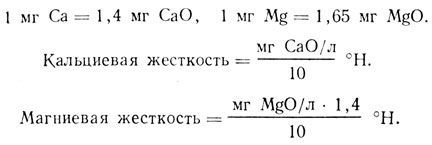
В настоящее время жесткость воды часто приводится прямо в миллиграм-эквивалентах. 1 мг-экв = 28 мг CaO/л = 2,8°Н; 1°Н = 0,357 мг-экв/л.
Для производственных целей на пивоваренных заводах используются в зависимости от местных условий грунтовые, родниковые и поверхностные воды. Грунтовые воды обычно наиболее чистые по биологическому составу, а именно потому, что при инфильтрации в глубине задерживается большая часть микроорганизмов. Если же они задерживаются в слоях, из которых не могут выщелачивать много солей, то это лучшие питьевые и производственные воды. Родниковые воды это тоже грунтовые воды, однако при самопроизвольном выходе на поверхность они могут перемешиваться с поверхностными водами или загрязняться другим путем. В табл. 5 приведена классификация воды по общей жесткости.

Таблица 5. Показатели жесткости различных вод
Поверхностные воды питаются как родниковыми, так и атмосферными водами. Их более высокая температура, а у текущих и движение, увеличивают потерю углекислого газа, задерживающего компоненты временной жесткости в растворе, поэтому эти воды бывают более мягкими. Их химический состав очень подвижен. Кроме того, они бывают более или менее загрязнены, главным образом при прохождении через города и промышленные центры. В бродильном производстве поверхностные воды можно использовать в качестве производственных только после предварительной обработки.
Чехословацкие пивоваренные заводы до недавнего времени почти повсеместно снабжались обычной грунтовой водой из собственных источников, часто пригодной даже в исходном виде для производства светлых сортов пива чешского типа. Недостаток грунтовой воды, наблюдаемый в настоящее время, вызван, с одной стороны, общим сокращением осадков в среднеевропейском районе, и с другой - ростом потребления воды в промышленности, более высокими требованиями к гигиене и как следствие повышенным потреблением воды населением. В последние десятилетия уровень грунтовых вод постоянно падает и тем самым уменьшается продуктивность скважин. В этих условиях некоторые пивоваренные заводы вынуждены использовать также и поверхностные воды, соответственно обработанные.
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://wine.historic.ru/ 'Виноделие как искусство'