
Общие формулы для вычисления Eh, rН2, Ох и Оп
ОВ-потенциал (Eh) вина. Ниже приводится общее уравнение, выведенное Нернстом:
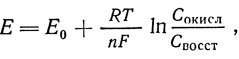
где Е - окислительно-восстановительный потенциал, в;
Сокисл - концентрация ( точнее, активность) окисленной формы анализируемой пробы вина (в некоторых руководствах Сокисл обозначается как Ох);
С восст - концентрация (точнее, активность) восстановленной формы анализируемой пробы вина (в некоторых руководствах Свосст обозначено как Red);
R-газовая постоянная, равная 8,310 дж;
Т-абсолютная температура (273+t °С), °К;
F -число Фарадея, равное 96 494 кулонам;
n - число электронов, теряемых или получаемых при превращении восстановленной формы в окисленную (или обратно);
Е0 - нормальный потенциал, измеренный при Сокисл = Cвосст.
Когда в формулу введены числовые значения известных констант, а вместо натурального логарифма применен десятичный, то при 18°С формула приобретает следующее окончательное выражение:
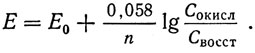
На практике Eh определяют обычно не в вольтах, а в милливольтах. При этом ОВ-потенциал выражают не только одной буквой Е, а в виде Eh, потому что данные измерений условлено относить к показаниям водородного электрода (h).
ОВ-потенциал обычно измеряют с помощью платинового и каломельного электродов. Каломельный электрод является электродом сравнения. Его показания по отношению к принятому за эталон водородному электроду выше на 250,3 мв при 18 °С.
Поэтому после измерения при помощи потенциометра э. д. с. в замкнутой цепи аккумулятор - платиновый электрод - вино - каломельный электрод - аккумулятор к найденной величине э. д. с. в милливольтах прибавляют 250,3 мв, если измерение выполнялось при температуре 18 °С. Но так как температура вина в момент измерения может быть иной, необходимо вводить поправку. Измерение э. д. с. обычно выполняется в интервале от 15 до 25 °С. Для облегчения расчетов ниже приводится табл. 13.
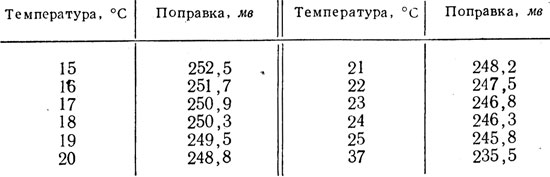
Таблица 13. Поправочные коэффициенты на каломельный электрод и температуры
П. К. Агасяном и А. А. Усовым предложена номограмма, которая позволяет сократить время вычисления Eh и некоторых других показателей [3].
rН2 вина. Так как окислительно-восстановительный потенциал зависит от величины рН (при увеличении рН на единицу ОВ-потенциал становится меньше на 57,7 мв при 18 °С), то для сравнения общего состояния окислительно-восстановительных систем вин с различным значением рН Кларком был предложен показатель rН2.
rН2 вычисляют по формуле:
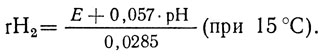
При 30 °С числовые значения в формуле имеют следующее выражение:
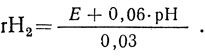
Прежде чем получить значение rН2, необходимо определить величины Eh и рН в исследуемой пробе. На основании полученных данных производят вычисление rН2.
Кислородное (Ох) и перекисное (Оп) числа. Наиболее пока распространенным на винзаводах является индигокарминный метод определения кислорода и перекисей, не требующий сложного аппаратурного оформления.
Кислородное число Ох включает кислород растворенный (Ор) и кислород перекисей (Оп). Следовательно, Ох = Ор+Оп.
Ох, Ор и Оп выражают обычно в мг/л и весьма редко (главным образом в иностранной литературе) в мл/л.
Оп вычисляют по формуле: Оп = Ох-Ор.
Методы определения Ох и Оп подробно изложены П. В. Кочерга [4], а также в VII томе трудов ВНИИВиВ "Магарач" [2].
Наибольшую перспективу имеют физические методы определения кислорода в винах [5, 6, 44].
Восстановительная способность вина (Вс, или Itt) определяется при помощи титрования проб вина раствором 2,6-дихлорфенолиндофенола. В зависимости от скорости исчезновения окраски дается заключение о величине Вс. Подробное описание метода дано в VII томе трудов ВНИИВиВ "Магарач" [2].
Способы определения других компонентов вин описаны в книгах: А. М. Фролова-Багреева, Г. Г. Агабальянца "Химия вина"; Г. Г. Агабальянца "Химико-технологический контроль производства Советского шампанского"; С. Г. Моргенштерна "Технохимический контроль в винодельческой промышленности. Руководство для лабораторий по контролю"; А. В. Короткевича, Л. И. Рыковой "Руководство по химии вина".
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://wine.historic.ru/ 'Виноделие как искусство'