
Влияние воды на кислотность сусла и пива
Естественную кислотность промежуточных пивоваренных продуктов и конечных продуктов определяют фосфаты калия, содержащиеся в солоде. При этом кислый первичный фосфат калия KH2PO4 преобладает над вторичным фосфатом калия K2HPO4. Оба действуют одновременно как буферные растворы. В водном растворе этих солей дигидрофосфатные H2PO4-, моногидрофосфатные HPO42-, а также фосфатные PO33- ионы находятся в равновесии. Их соотношение зависит от pH; чем кислее раствор, тем выше концентрация дигидрофосфатных ионов H2PO4.
По отношению к индикаторам растворы первичных фосфатов в результате частичной ионизации дигидрофосфатного иона реагируют кислотным образом:
H2PO4-⇔HPO2-4+H+.
Вторичные фосфаты реагируют как слабощелочные, поскольку ион гидрофосфата гидролизуется
HPO2-4+H++OH-⇒H2PO-4+OH-.
Растворы нормальных фосфатов реагируют по той же причине как сильнощелочные
PO3-4H++OH-⇔HPO2-4+ОН-.
Из минеральных компонентов воды карбонатные ионы HCO3 снижают естественную кислотность сусла пропорционально щелочности. И, наоборот, ионы кальция Ca2+ и магния Mg2+ повышают кислотность, и тем самым частично парализуют вредное влияние карбонатных ионов.
Снижение естественной кислотности (повышение pH) заторов, сладкого сусла и сусла охмеленного с точки зрения технологического процесса всегда отрицательно. Это проявляется в затруднительном осахаривании заторов, медленной фильтрации сусла, которое при этом недостаточно прозрачно, в более темных заторах и сусле и менее интенсивном выделении бруха при кипячении сусла с хмелем, а иногда и в более низком выходе экстракта. Пиво из сусла с более высоким pH бывает неприятно горьким и склонным к биологической нестойкости.
Реакции, которые протекают между анионами и катионами, поставляемыми, с одной стороны, солодом, с другой - водой, идущей на приготовление пива в условиях затирания довольно сложны. Поскольку они влияют на формирование вкусовых качеств каждого сорта пива, на них издавна было сосредоточено внимание теоретиков и практиков. По этому вопросу имеется обширная библиография. Первые подлинные данные относятся к Виндишу (1910), который решил всю проблему еще не будучи знаком с теорией электролитической диссоциации; он пришел к следующим выводам.
Первичный фосфат калия реагирует с бикарбонатом кальция таким образом:
2KH2PO4+Ca(HCO3)2=CaHPO4+K2HPO4+2H2O+2CO2.
Если пивоваренная вода богата бикарбонатом кальция, т. е. имеет высокую временную жесткость, то реакция протекает так:
4KH2PC4+3Ca(HCO3)2=Ca3(PO4)2+2K2HPO4+6H2O+6CO2.
В обоих случаях из двух молекул первичного фосфата калия образуется одна молекула вторичного фосфата, тем самым снижается кислотность сусла. Вторичные фосфаты и нормальные (третичные) фосфаты кальция выпадают из раствора в нерастворимый осадок.
С бикарбонатом магния происходят следующие реакции:
2KH2PO4+Mg(HCO3)2=MgHPO4+K2HPO4+2H2O+2CO3;
4KH2PO4+3Mg(HCO3)2=Mg3(PO4)2+2K2HPO4+6H2O+6CO2.
Здесь тоже образуется одна молекула вторичного фосфата калия, однако одновременно возникающий вторичный фосфат магния в отличие от фосфата кальция тоже растворим., а нормальный (третичный) фосфат магния растворим частично.
С щелочными бикарбонатами протекает следующая реакция:
2KH2PO4+2NaHCO3=K2HPO4+Na2HPO4+2H2O+2CO2.
Следовательно, из каждой молекулы образуется эквивалентное количество вторичного щелочного фосфата.
Из приведенных уравнений вытекает, что наиболее сильно подщелачивают сусло щелочные бикарбонаты, потом магния и менее всего кальция.
Нейтральные кальциевые и магниевые соли сильных кислот реагируют с вторичным фосфатом калия следующим образом:
4KH2PO4+3CaSO4=Ca3(PO4)2+ 2KH2PO4+3K2SO4.
Три молекулы сульфата кальция (гипс) дают две молекулы первичного фосфата калия. Одновременно возникший нормальный (третичный) фосфат кальция нерастворим и поэтому выпадает из раствора. Тем самым кислотность сусла повышается (pH понижается).
Эти основные реакции, сформулированные Виндишом, в последнее время были пересмотрены. Гонкинс и Амфлет [2] подтвердили, что щелочное действие бикарбонатов возрастает по порядку Ca, Mg, Na или K. Однако из их открытия вытекает, что при обычных температурах затирания даже при перемешивании не выделяется весь углекислый газ и поэтому реакции протекают полностью только при кипячении затора и сусла. Однако и после основательного устранения углекислого газа pH не поднимается, а даже несколько падает. Эта аномалия объясняется реакциями ионов Ca2+ и Mg2+, которые повышают кислотность. При использовании воды, бедной Ca2+ и Mg2+, кислотность тоже несколько возрастает, так как влияют Ca2+ и Mg2+ из солода.
В противоречии с открытием Виндиша (по данным указанных авторов) кислотность возрастает не при реакции ионов Ca2+ и Mg2+ с вторичным фосфатом кальция, а при реакции с органическими фосфатами, главным образом фитином, а возможно и с белками
протеин H+Ca2+=протеинат=Ca+2H+.
Реакции этого типа протекают без нагрева очень медленно. Поэтому повышение кислотности в значительной мере проявляется только при кипячении.
По мнению Берглунда [3] снижение кислотности под влиянием бикарбонатов щелочноземельных металлов является результатом взаимодействия систем карбонатного буфера (HCO3--CO2) в воде и фосфатного буфера (HPO42+-H2PO4-) из солода. Карбонатная система сдвигает pH фосфатной системы в щелочную сторону, в то время как фосфатная система, наоборот, сдвигает pH карбонатной системы в более кислую область. Результат зависит от молекулярных концентраций в среде, т. е. от буферной способности. Эго понятие дополняет результаты Виндиша и уточняет их в соответствии с современными научными данными, В связи с вышесказанным можно сделать вывод, что подщелачивающее действие воды на приготовления пива пропорционально ее щелочности, определяемой титрованием по метиловому оранжевому. Нейтрализация не происходит в начале затирания, а проявляется постепенно по мере удаления углекислого газа, который освобождается в результате разложения бикарбонатов:
HCO3-+H+=H2O+CO2.
В противоречии с приводившимися более ранними точками зрения Берглунд доказывает, что вместо нормального (третичного) фосфата кальция при осаждении из водных растворов всегда образуется его сдвоенное соединение с гидроксидом кальция 3Ca3(PO4)2Ca(OH)2, называемое апатитом. Остальные фосфаты кальция тоже постепенно гидролизуются в апатит, который является наиболее стойким соединением во всем диапазоне pH.
Вторичный фосфат кальция осаждается только при низких температурах затирания. Тем самым раствор обедняется на моногидрофосфатные ионы HPO2-4, так что отношение H2PO-4:HPO-24 в фосфатном буфере возрастает в пользу дигидрофосфатных ионов H2PO-4 кислотность раствора повышается (pH понижается).
Количественные отношения сформулировал Кольбах [4]. Бикарбонатный ион HCO-3,содержащийся в природных водах, повышает pH, а ионы кальция Ca2+ и магния Mg2+ снижают pH сусла. Mg2+ снижает pH в 2 раза меньше, чем Ca2+. Для компенсации повышения pH, вызванного 1 эквивалентом HCO-3, необходимо 3,5 эквивалента Ca2+. Из этих зависимостей можно высчитать остаточную щелочность, характеризующую изменение pH сусла под влиянием воды. Эта часть общей щелочности не компенсируется ионами Ca2+ и Mg2+. Для их расчета необходимо знать расход т 0,1 н. раствора HCl для титрования 100 мл воды с метиловым оранжевым.
Процесс расчета виден из инструктивного примера, который относится к воде пивоваренного завода в Бурбоне (по Ллойд Хинду):
m = 4,7 мл 0,1 н. раствора HCl на 100 мл;
CaO = 345 мг/л;
MgO = 103 мг/л.
Общая щелочность 4,7 мг-экв/л, т. ё. 4,7•2,8=13,2 °Н.
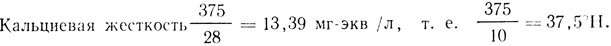
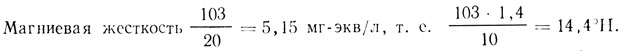
Поскольку снижение pH под влиянием магниевой жесткости в 2 раза меньше, чем под влиянием кальциевой жесткости, то общее влияние воды на снижение pH можно выразить одним числом:
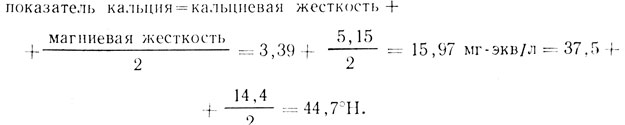
Компенсация 1°Н общей щелочности требует 3,5 - показателя кальция.
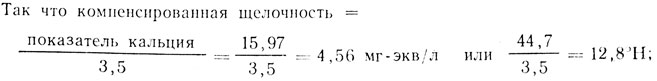
остаточная щелочность = общая щелочность - компенсированная щелочность = 4,71-4,56 = 0,15 мг-экв/л или 13,2-12,8 = 0,4°Н.
Остаточная щелочность 3,57 мг-экв/л = 10°Н повышает pH готового сусла (12 мас.%) приблизительно на 0,3 по сравнению с дистиллированной водой. Для производства светлых сортов пива хорошо подходят воды, остаточная щелочность которых не превышает 0,357 мг-экв/л = 1°Н. При такой низкой остаточной щелочности, которая получилась в приведенном примере, можно предположить, что pH сусла из этой воды приблизительно такой же, как при использовании дистиллированной воды.
Снижение pH под влиянием ионов Ca2+ и Mg2+ проявляется в готовом пиве, в то время как декарбонизацией воды снижается только pH сусла. С точки зрения щелочности вода для приготовления пива тем лучше, чем ниже щелочность по метиловому оранжевому и одновременно выше содержание Ca2+.
Влияние воды на вкус пива
Соли, содержащиеся в пивоваренной воде, если их много, отражаются на вкусе пива, даже независимо от pH. Это важное влияние однако изучено недостаточно.
В последнее время экспериментальные работы опубликованы Де Клерком [5], далее Краусом с сотрудниками [6], а в ЧССР - Салачем с сотрудниками [7].
Первый из авторов установил, что сульфатные ионы SO2-4 дают пиво на вкус терпкое и исключительно горькое, в то время как Виндиш утверждал, что такое пиво имеет жесткий вкус. Отрицательное вкусовое влияние сульфатных ионов не наблюдается вплоть до их содержания, соответствующего 20-30°Н постоянной жесткости.
Силикатные ионы SiO2-3 оказывают влияние на вкус косвенным путем тем, что могут помешать брожению уже в обычном количестве от 10 до 30 мг/л и что способствуют образованию коллоидного помутнения в пиве. Силикаты, содержащиеся в пиве, происходят большей частью из солода, в то время как с водой их попадает в пиво относительно немного.
Нитратные ионы NO-3 в больших концентрациях явно отрицательно влияют на вкус пива. Кроме того, нитраты при брожении частично восстанавливаются в нитриты; нитритный ион NO-2 токсически воздействует на дрожжи. Отрицательное вкусовое влияние нитритов обнаруживается при концентрации от 25 мг/л.
Хлорные ионы Cl- придают пиву более тонкий и сладкий вкус. Они считаются безвредными даже при высоких концентрациях.
Железо Fe2+ и Fe3+ может ускорять дегенерацию дрожжей. В пиве легко возникает коллоидное помутнение. При высоких концентрациях пиво имеет неприятный вкус, интенсивный цвет и коричневую пену. Допускается от 0,2 до 0,5 мг Fe/л. Влияние марганца такое же, однако намного сильнее.
Магниевые ионы Mg2+ при высоком содержании неблагоприятно влияют на вкус. Граница колеблется около 15°Н магниевой жесткости.
Натриевые ионы Na+ всегда оказывают неблагоприятное влияние на вкус пива.
При определении влияния воды на вкус пива по Кольбаху [4] необходимо принимать во внимание также соли из солода. Лагерное пиво из воды обычного состава содержит в 1 л приблизительно около 1960 мг золы; если использовать дистиллированную воду, содержание золы снизится приблизительно до 1800 мг/л.
Краус и сотрудники доказали, что пиво из воды, полностью освобожденной от солей, на вкус почти такое же, как пиво из воды с общей жесткостью от 6 до 10°Н. Разница во влиянии Ca2+ и Mg2+ на вкус пива по мнению этих авторов незначительна. Почти никакой разницы во вкусе не возникает под влиянием хлорида кальция и магния, сульфата кальция и магния или карбоната кальция и магния. Хлорид кальция придает неприятно соленый вкус уже при содержании, соответствующем больше 20°Н. Магниевый ион вреден в той же концентрации. Кальциевый ион вызывает неприятно горький вкус.
Из результатов исследований Салача и сотрудников вытекает, что из чехословацких пивоваренных вод лучше всего мягкие воды, по составу похожие на пильзенские воды. Было установлено, что оптимальное отношение временной жесткости к постоянной 1:1, при этом более существенным фактором, чем уровень общей жесткости, является содержание HCO-3. Если пиво из мягкой и среднежесткой воды не было удовлетворительным с точки зрения вкуса, то это было вызвано менее благоприятным соотношением Mg2+:Ca2+ и одновременно более высоким содержанием NO-3. Пиво из воды с отношением временной жесткости к постоянной как 1:2 с точки зрения вкуса лучше, чем пиво из воды с преобладающей временной жесткостью. Пиво из жесткой и очень жесткой воды, удовлетворительно, если содержание Ca2+ в несколько раз превышает содержание Mg2+.
Различный состав вод, применяемых для приготовления пива, проявляется в разной степени сбраживания его. Обычно наиболее глубоко сбраживается пиво из воды с низким содержанием солей (пильзенская вода), если не действуют одновременно другие факторы; несколько меньше сбраживается пиво из воды с отношением временной жесткости к постоянной как 1:1 и еще меньше пиво из воды с преобладающим содержанием сульфитов. По Гонкинсу и Амфлету [2], под действием сульфата кальция при кипячении осаждается фитин; его компонент иноситол необходим для дрожжей и недостаток его снижает бродильную активность. Воды с преобладающей временной жесткостью способствуют при варке сусла с хмелем образованию молекулярной формы горьких хмелевых веществ, что проявляется в резком, горьком вкусе пива.
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://wine.historic.ru/ 'Виноделие как искусство'